1、选择题 下列说法中正确的是(? )
A.原子核外的各个电子层最多容纳的电子数为2n2个
B.原子核外的每个电子层所容纳的电子数都是2n2个
C.原子的最外层有1~2个电子的元素都是金属元素
D.稀有气体元素原子的最外层电子数都是8
2、填空题 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中B所处的周期序数与族序数相等。填写下列空白。
?
(1)写出C的氧化物的一种用途:?
(2)B单质与Fe2O3反应时,每消耗13.5g B时放热213kJ,该反应的热化学方程式是?
(3)为防止A元素的氧化物AO2污染空气,科学家寻求合适的化合物G和催化剂,以实现反应:
AO2+X催化剂A2 +H2O+n Z(未配平,n可以为0)。上述反应式中的X不可能是?(填标号)。
a.NH3?b.CO?c.CH3CH2OH? d.H2O2
(4)A元素的最简单氢化物甲、D元素的最高价氧化物对应的水化物乙都是很重要的基础化工原料。
①一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是?(选填序号)。
选项
| a
| b
| c
| d
|
x
| 温度
| 温度
| 加入H2的物质的量
| 加入甲的物质的量
|
y
| 甲的物质的量
| 平衡常数K
| 甲的转化率
| 生成物物质的量总和
|
?
②25℃时,往a mol·L-1的甲的水溶液中滴加0.01 mol·L-1乙溶液,当两种溶液等体积混合时,溶液呈中性(设温度不变)。滴加过程中溶液的导电能力?(填“增强”、“减弱”或“不变”);
所得混合溶液中A、D两种元素的物质的量的关系为:A?2D(填“大于”、“等于”或“小于”);甲中溶质的电离平衡常数Kb=?(用含a的代数式表示)。
3、推断题 短周期元素在元素中占有重要地位。X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如下变化: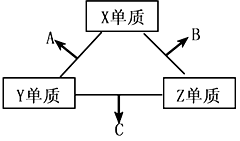 ?
?
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。请回答下列问题:
(1)X元素在周期表中的位置是________周期____________族?。
(2)分析同主族元素性质的递变规律,发现B、C物质沸点反常,这是因为它们的分子之间存在_____________?。
(3)在C分子中,Y原子的杂化方式为?,与Y原子同主族在第四周期的元素原子基态电子排布式是?。
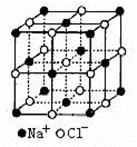
(4)NaCl的晶体结构如右上图所示,若将晶胞面心和体心的原子除去,顶点的钠离子换为Xn+(X代表某元素符号)离子,棱上的Cl-换为O2-,就得到X的氧化物的晶体结构。则该X的氧化物的化学式为?。
4、填空题 完成下面表格: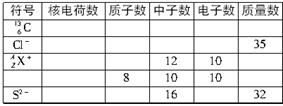
5、填空题 A、B、R、D、E、F是六种原子序数依次增大的短周期元素, 其中有两种非金属元素位于同一主族。已知A、B、D均能与R形成原子(或离子)个数不同的几种常见化合物。请回答下列有关问题。
(1)仅由上述信息就可以确定的元素(写出代号与元素符号)是________________,若X、Y是D、F形成的最高价氧化物对应的水化物,浓度均为0.1mol/L的X、Y溶液的pH之和为14,则X、Y的晶体熔点相对高低为(写化学式)______?______
(2) A与B、E均可形成正四面体构型的气态分子Q、P,又知P的燃烧热为1430kJ/mol,则其燃烧的热化学方程式___________?_________
(3) 上述六种元素间能形成多种常见二元化合物,其中存在两类化学键的物质的电子式为_____?__(写一种即可)
(4) R能形成多种单质,如R2、R3,研究表明,新近制得的一种组成为R4的分子中,每个R原子均与另外两个R原子各形成一个键,下列有关R4的说法中正确的是__?_____
①R4与R3、R2互为同位素?②R4不能与A、B、D的单质反应
③R4中各原子最外电子层均为8电子结构?④R4是一种新型化合物