1、选择题 针对下图装置的说法中,正确是
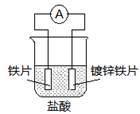
A.溶液中pH值明显下降
B.铁片为正极,镀锌铁片为负极
C.阴极的电极反应式:Fe-2e→Fe2+
D.电子由锌经溶液流向铁
参考答案:B
本题解析:A、锌的金属性强于铁,因此锌是负极,失去电子,铁是正极溶液中的氢离子得到电子,所以溶液中pH值明显升高,A不正确;B、铁片为正极,镀锌铁片为负极,B正确;C、原电池分为正极和负极,没有阴阳极,C不正确;D、电子由锌经导线流向铁,D不正确,答案选B。
本题难度:一般
2、选择题 下列四组原电池,其中放电后,电解质溶液质量增加,且在正极有单质生成的是
A.Cu、Ag、AgNO3溶液 B.Zn、Cu、稀H2SO4
C.Fe、Zn、ZnSO4溶液 D.Fe、C、Fe2(SO4)3溶液
参考答案:B
本题解析:
A、Cu+2 AgNO3=Cu(NO3)2+2Ag,正极有单质生成,但溶液质量减少,故A不符合题意;
340 188
B、Zn + H2SO4 =" Zn" SO4 + H2↑,溶液质量增加,正极有氢气生成,故B符合题意;
98 161
C、不能自发地进行氧化还原反应,不能构成原电池,故C不符合题意;
D、Fe+Fe2(SO4)3=3FeSO4,溶液质量增加,但没有单质生成,故D不符合题意。
考点:考查原电池反应原理
点评:本题考查了原电池的反应原理,难度不大。解题时应注意从原电池的总反应上分析质量的变化关系。
本题难度:困难
3、填空题 (14分)天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4。

①写出铜电极表面的电极反应式 。
②为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
①该反应的平衡常数表达式为 。
②在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。

(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为 。
参考答案:(1)CO2+8e-+8H+=CH4+2H2O (2分) 硫酸 (2分)
(2)2NH4HS+O2=2NH3·H2O+2S↓ (2分)
(3)①K=c2(CO)·c2(H2)/ c(CO2)·c (CH4) (2分) ②小于(2分) 大于 (2分)
(4)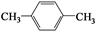 (2分)
(2分)
本题解析:(1) ①分析题给装置知,铜电极表面CO2转化为 CH4,电解质溶液呈酸性,利用氢离子和水平衡电荷和原子,电极反应式CO2+8e-+8H+=CH4+2H2O;②盐酸易挥发,为防止副反应的发生,可向装置中加入少量硫酸;(2)一定条件下向NH4HS溶液中通入空气,得到单质硫和一水合氨,该反应的化学方程式2NH4HS+O2=2NH3·H2O+2S↓;(3)①根据CO2(g)+CH4(g)  2CO(g)+2H2(g) 写出该反应的平衡常数表达式为K=c2(CO)·c2(H2)/ c(CO2)·c (CH4);②根据图像知,当温度相同时,压强为P1时甲烷的平衡转化率比压强为P2的高,说明平衡正向移动,该反应的正反应为气体物质的量增大的反应,改变的条件为减小压强,则压强P1小于P2(填“大于”或“小于”);压强为P2时,Y点CH4的转化率比平衡时低,,要想达到平衡状态,反应正向进行,v(正) 大于v(逆);(4)根据题给信息知,芳香烃X的相对分子质量为106,分子中含有2中氢原子,为对二甲苯,结构简式为
2CO(g)+2H2(g) 写出该反应的平衡常数表达式为K=c2(CO)·c2(H2)/ c(CO2)·c (CH4);②根据图像知,当温度相同时,压强为P1时甲烷的平衡转化率比压强为P2的高,说明平衡正向移动,该反应的正反应为气体物质的量增大的反应,改变的条件为减小压强,则压强P1小于P2(填“大于”或“小于”);压强为P2时,Y点CH4的转化率比平衡时低,,要想达到平衡状态,反应正向进行,v(正) 大于v(逆);(4)根据题给信息知,芳香烃X的相对分子质量为106,分子中含有2中氢原子,为对二甲苯,结构简式为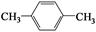 。
。
考点:考查电极方程式的书写,化学平衡及有机物结构式的确定。
本题难度:困难
4、选择题 一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。下列对该燃料电池的说法中,正确的是( ?)
A.在熔融的电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-=4CO2+5H2O
参考答案:BC
本题解析:在熔融的电解质中,O2-应由正极移向负极,故A项错误;原电池反应是使氧化还原反应分别在两个电极进行,通丁烷的电极是负极,通空气的电极是正极,电池的总反应是2C4H10+13O2=8CO2+10H2O,故B、C两项正确,D项错误。
本题难度:一般
5、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ? ΔH1=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?ΔH2=-1 160 kJ·mol-1
若在标准状况下用CH4还原4.48 L NO2生成N2,则下列说法中正确的是
( )。
A.该过程吸收的热量为86.7 kJ
B.此过程中需要标准状况下CH4气体1.12 L
C.转移的电子数为0.8NA
D.已知2NO(g)+O2(g)=2NO2(g) ΔH=-114 kJ·mol-1,则CH4的燃烧热是802 kJ·mol-1
参考答案:C
本题解析:根据盖斯定律将两个热化学方程式相加并除以2可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH2=-867 kJ·mol-1,为放热反应,A项错误;B项计算错误,应需要标准状况下2.24 L CH4;表示甲烷燃烧热必须是生成液态水,由所给条件不能计算,故D项错误。
本题难度:简单