1、选择题 由铝,铁,铜,银和稀硫酸,可以组成原电池的总数为
A.3种
B.4种
C.5种
D.6种
参考答案:C
本题解析:构原电池的条件为:1、要有两个活动性不的材料作电极;2、要有电解质溶液;3、要形成闭合回路;4、能自发进行氧化还原反应;所以组成的原电池的组合有:1、铝,铁;2、铝,铜;3、铝,银;4、,铁,铜,5、铁,银;共有五组可能的情况;
本题难度:一般
2、选择题 下列关于铜电极的叙述中正确的是( )
A.铜锌原电池中铜是负极
B.用电解法精炼粗铜时粗铜作阳极
C.在铁上电镀铜时用铜作阴极
D.电解稀硫酸时用铜作阳极,阳极产生氧气
参考答案:A.铜锌原电池中铜是正极,锌是负极,故A错误;
B.电解精炼铜时,粗铜作阳极,纯铜作阴极,在阴极上析出铜,粗铜中的杂质进入电解液而分离,故B正确;
C.在铁上电镀铜时,铁作阴极,铜作阳极,故C错误;
D.铜作阳极电解时,铜失去电子生成铜离子,故D错误.
故选B.
本题解析:
本题难度:简单
3、填空题 新型锂离子电池材料Li2 MSiO4(M为Fe,Co,Mn,Cu等)是一种发展潜力很大的电池电极材料。工业制备Li2 MSiO4有两种方法:
方法一:固相法,2Li2SiO3+ FeSO4 ?Li2FeSiO4 +Li2SO4 +SiO2
?Li2FeSiO4 +Li2SO4 +SiO2
方法二:溶胶—凝胶法,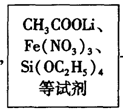
 Li2FeSiO4
Li2FeSiO4
(1)固相法中制备Li2 FeSiO4过程采用惰性气体气氛,其原因是?;
(2)溶胶—凝胶法中,检查溶液中有胶体生成的方法是?;生产中生成Imol Li2FeSiO4整个过程转移电子物质的量为?mol;
(3)以Li2 FeSiO4和嵌有Li的石墨为电极材料,含锂的导电固体作电解质,构成电池的总反应式为:Li+ LiFeSiO4 ?Li2FeSiO4则该电池的负极是____?;充电时,阳极反应的电极反应式为?;
?Li2FeSiO4则该电池的负极是____?;充电时,阳极反应的电极反应式为?;
(4)使用(3)组装的电池必须先____?。
参考答案:(11分)(1)防止Fe2+被氧化成Fe3+ (2分) ;?
(2)用一束强光照射溶液,从侧面能观察到一条光亮的通路。(2分);1mol (2分)
(3)嵌有Li的石墨(2分) Li2FeSiO4-e-=LiFeSiO4+Li+(2分) (4)充电(1分)
本题解析:(1)Fe2+具有还原性,故采用惰性气体气氛的原因是防止Fe2+被氧化成Fe3+。
(2)检查有无胶体生成,利用胶体的特征现象,即用一束强光照射溶液,从侧面能观察到一条光亮的通路。
(3)电池的负极失去电子、化合价升高,故负极是嵌有Li的石墨。阳极失去电子,化合价升高,电极式为Li2FeSiO4-e-=LiFeSiO4+Li+。
(4)使用(3)组装的电池必须先充电。
点评:本题考查的是锂电池的制备原理的信息题,题目难度大,利用好题中信息是解题的关键。
本题难度:一般
4、选择题 铅蓄电池是广泛应用于汽车、柴油机车等的启动电源。产生电能时的电极反应分别为:
Pb+SO42
参考答案:
本题解析:
本题难度:困难
5、选择题 原电池电极的“正”与“负”不仅与电极材料的性质有关,也与电解质溶液有关.下列说法中正确的是?
[? ]
A.由Fe、Cu和FeCl3溶液组成的原电池中,负极反应式为:Cu-2e-===Cu2+
B.由Al、Cu和稀硫酸组成的原电池中,负极反应式为:Cu-2e-===Cu2+
C.由Al、Mg和NaOH溶液组成的原电池,负极反应式为:Al+4OH--3e-===AlO2-+2H2O
D.由Al、Cu和浓HNO3溶液组成的原电池中,负极反应式为:Al-3e-===Al3+
参考答案:C
本题解析:
本题难度:一般