1、计算题
(1)金属锰可以用四氧化三锰为原料通过铝热法来制备。试写出配平的化学方程式。
(2)CS2是一种有恶臭的液体,把它滴入硫酸酸化的高锰酸钾水溶液,将析出硫磺,同时放出CO2,写出配平的化学式方程式。
参考答案:(1)3Mn3O?4+8Al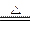 9Mn+4Al2O3
9Mn+4Al2O3
(2)5CS2+4KMnO4+6H2SO4=10S↓+5CO2↑+4MnSO4+2K2SO4+6H2O
本题解析:CS2中C的氧化数为+4,S的氧化数为-2
(1)3Mn3O?4+8Al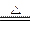 9Mn+4Al2O3
9Mn+4Al2O3
(2)5CS2+4KMnO4+6H2SO4=10S↓+5CO2↑+4MnSO4+2K2SO4+6H2O
本题难度:一般
2、选择题 水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y+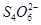 +2H2O下列说法中,不正确的是?(?)
+2H2O下列说法中,不正确的是?(?)
A.S2O32-是还原剂
B.Y的化学式为Fe2O3
C.a=4
D.每有1mol O2参加反应,转移的电于总数为4 mol
参考答案:B
本题解析:根据题意可知:Fe2+和S2O32-作还原剂失去电子。氧气得到电子作氧化剂。每有1mol O2参加反应,转移的电于总数为4 mol结合原子守恒可得Y的化学式为Fe3O4,a=4.选项为 :B。
本题难度:一般
3、选择题 有关反应5Cu + 4H2SO4(浓) Cu2S + 3CuSO4 + 4H2O的叙述正确的是
Cu2S + 3CuSO4 + 4H2O的叙述正确的是
A.氧化剂与还原剂的物质的量之比为1:5
B.每有1 mol Cu参加反应时转移2 mol e-
C.氧化产物只有CuSO4
D.浓硫酸既是氧化剂又是还原剂
参考答案:A
本题解析:根据方程式可知,在反应中铜的化合价从0价部分升高到+2价,部分升高到+1价,共计失去2×3+1×2=8个电子。S元素的化合价从+6价降低到-2价,得到8个电子,则氧化剂与还原剂的物质的量之比为1:5,A正确;每有1 mol Cu参加反应时转移8mol÷5=1.6mol e-,B不正确;氧化产物是硫酸铜和硫化亚铜,C不正确;浓硫酸起氧化剂和酸性的作用,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题难易适中,基础性强。该题的关键是准确判断出有关元素的化合价变化情况,然后依据有关的概念灵活运用即可。在进行有关计算时,要利用好电子的得失守恒。
本题难度:一般
4、填空题 (1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
参考答案:(1)溶液由无色变为紫色;0.25 (2)Cl2 (3) ①10、4、14、3、5、4、14;②Bi2(SO4)3
③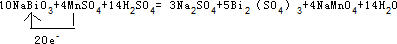
(4)S2O32-+2H+=S↓+SO2↑+H2O
本题解析:(1)MnO4-为紫色,其它离子均为无色,则反应的现象为溶液由无色变为紫色;Mn元素的化合价升高,S元素的化合价降低,有0.1mol还原剂(MnSO4)参加反应,则消耗氧化剂的物质的量为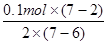 =0.25mol;
=0.25mol;
(2)硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,氯离子可能被氧化,则除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有Cl2;
(3)①Bi元素的化合价由+5价降低为+3价,Mn元素的化合价由+2价升高为+7价,结合电子守恒、原子守恒可知,反应为10NaBiO3+4MnSO4+14H2S04=3Na2S04+5Bi2(SO4)3+4NaMnO4+14H2O,故答案为:10;4;14;3;5;4;14;
②Bi元素的化合价降低,被还原,对应还原产物为Bi2(SO4)3;
③Mn失去电子,Bi得到电子,该反应中转移20e-,用单线桥表示该氧化还原反应为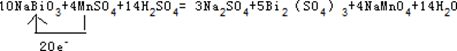 ;
;
(4)K2S2O3中滴加稀硫酸,发生氧化还原反应生成硫酸钾、S、二氧化硫和水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O,故答案为:S2O32-+2H+=S↓+SO2↑+H2O.
考点:考查氧化还原反应的有关判断与计算
本题难度:一般
5、选择题 用干燥的高锰酸钾可以制得极纯而干燥的氧气:KMnO4 MnO2+K2O+O2(240 ℃)。下列说法不正确的是(? )
MnO2+K2O+O2(240 ℃)。下列说法不正确的是(? )
A.每生成16 g氧气转移4 mol电子
B.相同质量的KMnO4分解,生成MnO2的反应比生成K2MnO4的反应放出更多氧气?
C.O2是氧化产物,MnO2是还原产物?
D.在此条件下,KMnO4的氧化性强于O2?
参考答案:A
本题解析:由观察法可知上述反应的方程式为4KMnO4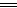 4MnO2+2K2O+3O2(240 ℃),故生成16 g氧气转移的电子的物质的量为2 mol;氧元素被氧化得到氧气,锰元素被还原得到二氧化锰。
4MnO2+2K2O+3O2(240 ℃),故生成16 g氧气转移的电子的物质的量为2 mol;氧元素被氧化得到氧气,锰元素被还原得到二氧化锰。
本题难度:一般