1、选择题 某元素的单质与足量浓HNO3反应时,参加反应的单质与HNO3的物质的量之比为1∶4,则反应后的产物中,该元素的价态可能为?
A.+1
B.+5
C.+3
D.+4
参考答案:D
本题解析:浓硝酸的还原产物是NO2,转移的电子是1.根据得失电子守恒可知生成4mol还原产物转移4mol电子,所以1mol单质失去4mol电子,化合价是+4价,答案选D。
本题难度:一般
2、选择题 已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是?(?)
A.KClO3是氧化剂
B.发生氧化反应与还原反应的氯元素的质量比为5:1
C.H2SO4既不是氧化剂又不是还原剂
D.1mol KClO3参加反应时有10mol电子转移
参考答案:D
本题解析:分析反应5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O可知,KCl中Cl元素由-1价升高为0,KClO3中Cl元素由+5价降低为0,A、含元素化合价降低的物质为氧化剂,则KClO3是氧化剂,正确;B、KCl为还原剂,被氧化,KClO3是氧化剂被还原,则被氧化与被还原的氯元素的质量比为5:1,正确;C、H2SO4中各元素的化合价在反应前后不变,则H2SO4既不是氧化剂又不是还原剂,正确;D、由反应可知,1mol KClO3参加反应时有5mol电子转移,错误。
本题难度:一般
3、选择题 含铬Cr2O72-废水用硫亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到nmolFeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是
A.消耗硫酸亚铁铵的物质量为n(3x+1)mol
B.处理废水中Cr2O72-的物质量为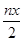 mol
mol
C.反应中发生转移的电子数为1.5nxmol
D.在FeO·FeyCrxO3中3x=y
参考答案:C
本题解析:A.由铁元素守恒,消耗硫酸亚铁铵的物质的量为n(y+1),又由FeO?FeyCrxO3电中性知3x+3y=6,代入前式得,消耗硫酸亚铁铵的物质的量为n(3-x);或由得失电子守恒得3x=y,代入得n×(1+y)mol=n×(3x+1)mol,A正确;B.根据铬原子守恒,Cr原子为nxmol,故Cr2O72-的物质的量为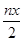 mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.
mol,B正确;C.得到nmolFeO·FeyCrxO3,则一共有nxmolCr原子参加反应,1molCr转移电子3mol,故转移的电子数为3nxmol,C错误;D、FeO·FeyCrxO3中,Fe为正三价,由得失电子守恒知3x-y=0,即3x=y,D正确.
选:C.
本题难度:一般
4、填空题 (6分)根据反应8NH3 + 3Cl2 ="=" 6NH4Cl + N2 ,回答下列问题:
(1) 还原剂是?(写化学式);
(2) 用双线桥法表示该反应电子转移的方向和数目;?
(3)当反应中转移1.806×1024个电子时,被氧化的气体在标准状况下的体积为?升。
参考答案:(1)NH3;(2分)?(2)略;(2分)?(3)22.4。(2分)
本题解析:略
本题难度:一般
5、填空题 (8分)铁屑可用于地下水脱氮,其实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5 mol/L盐酸中进行预处理。
Ⅱ、30 min后,用去离子水反复冲洗,至冲洗后液体的pH为中性。在N2保护下烘干备用。
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液。
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中。
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 。
(2)烘干时需要在N2保护下进行的原因是 。
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 。
(4)将酸性条件下,铁与NO3-反应的离子方程式补充完整:

参考答案:(1)Fe2O3+ 6H+= 2Fe3+ +3H2O (2)防止铁屑在空气中被氧化
(3)Fe2O3 (4)4 Fe + NO3-+ 10H+="4" Fe2+ + NH4+ +3H2O
本题解析:(1)盐酸与Fe2O3反应生成氯化铁和水,离子方程式为Fe2O3+6H+=2Fe3++3H2O;
(2)铁是活泼的金属,易被氧化,所以烘干时需防止铁屑在空气中被氧化,可用氮气作为保护气;
(3)滤液中含有氯化亚铁,氯化亚铁水解生成氢氧化亚铁和氯化氢,水解吸热,加热促进水解,且生成的氯化氢易挥发,因此得到氢氧化亚铁。氢氧化亚铁易被氧化,最终转化为氢氧化铁,灼烧氢氧化铁分解生成氧化铁;
(4)铁与NO3-反应生成Fe2+、NH4+和水,其中铁元素的化合价从0价升高到+2价,失去2个电子;N元素的化合价从+5价降低到-3价,得到8个电子,因此根据电子得失守恒以及原子守恒可知反应的方程式为4Fe+NO3-+10H+=4 Fe2++NH4++3H2O。
考点:考查物质性质实验探究、盐类水解以及氧化还原反应方程式的配平等
本题难度:一般