| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》试题特训(2019年最新版)(三)
2、选择题 下列叙述正确的是 |
3、填空题 有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是?(填序号,下同),既存在离子键又存在极性键的是?。
(2)②号物质的电子式为?、用电子式表示⑥号物质的形成过程:?。
4、填空题 (8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。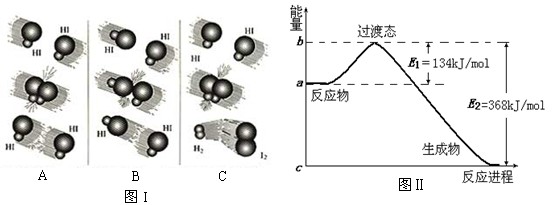
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
?(选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:?;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1?mol?化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C—Cl | H—Cl |
| 键能/ kJ·mol–1 | X | 243 | 330 | 432 |
5、选择题 已知:2CO(g)+O2(g)=2CO2(g)?△H=–566.0kJ/mol.由此判断CO的燃烧热是 ( ?)
A.-283.0kJ/mol
B.-566.0kJ/mol
C.283.0kJ
D.566.0kJ/mol
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《复合材料》.. | |