| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学反应与能量》试题特训(2019年最新版)(四)
参考答案: 本题解析: 本题难度:一般 2、选择题 下列叙述正确的是 |
参考答案:B
本题解析:A、放热反应中生成物总能量一定低于反应物总能量,而吸热反应中正好相反,A错误;B、可燃物燃烧均是放热反应,B正确;C、硝酸铵溶于水是物理变化,不是吸热反应,C错误;D、反应热只与反应物总能量和生成物总能量的相对大小有关系,与反应条件无关,D错误,答案选B。
考点:考查反应热的有关判断
本题难度:一般
3、填空题 有下列几种物质:①Ne、②NH4Cl、③NaOH、④Cl2、⑤CO2、⑥H2O、⑦Na2O2。
(1)上述物质中,属于共价化合物的是?(填序号,下同),既存在离子键又存在极性键的是?。
(2)②号物质的电子式为?、用电子式表示⑥号物质的形成过程:?。
参考答案:(10分)(1)⑤⑥;②③
(2)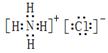 ;
;
本题解析:(1)全部由共价键形成的化合物是共价化合物,所以属于共价化合物的是CO2和H2O,答案选⑤⑥;一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是同一种非金属形成的共价键则是非极性键,如果是不同种非金属形成的共价键,则是极性键,所以既存在离子键又存在极性键的是氯化铵和氢氧化钠,答案选②③。
(2)氯化铵是离子化合物,电子式是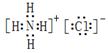 。水是由极性键形成的共价化合物,其形成过程可表示为
。水是由极性键形成的共价化合物,其形成过程可表示为 。
。
点评:该题是高考中的常见题型,属于基础性试题的考查,难度不大。明确化学键的含义以及化学键与化合物关系是答题的关键,有利于培养学生的逻辑思维能力和规范答题能力。
本题难度:一般
4、填空题 (8分)1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。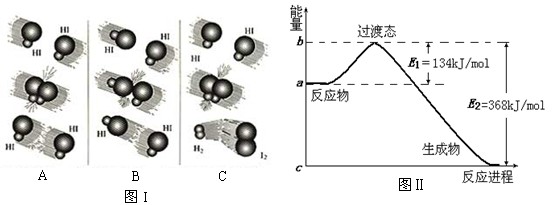
(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是
?(选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:?;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化。请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1?mol?化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 | C-H | Cl-Cl | C—Cl | H—Cl |
| 键能/ kJ·mol–1 | X | 243 | 330 | 432 |
参考答案:(8分)(1)C
(2)?NO2(g)+CO(g)=CO2(g)+NO(g);ΔH=-234?kJ/mol
(3)(见图)? (4)413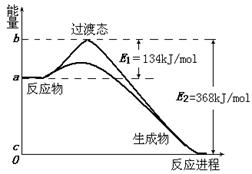
本题解析:(1)C中有产物氢气及碘蒸气的生成
(2)由图可知△H=-234kJ·mol-1
(3)加入催化剂,只是减小活化能,但起始状态并不改变,具体见图
(4) △H=4X+243-3X-330-432=-106kJ/mol,可推出X=413
本题难度:一般
5、选择题 已知:2CO(g)+O2(g)=2CO2(g)?△H=–566.0kJ/mol.由此判断CO的燃烧热是 ( ?)
A.-283.0kJ/mol
B.-566.0kJ/mol
C.283.0kJ
D.566.0kJ/mol
参考答案:A
本题解析:试题分析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以根据方程式可知,CO的燃烧热是-566.0kJ/mol÷2=-283.0kJ/mol,答案选A。
考点:考查燃烧热的计算和判断
点评:该题是基础性试题的考查,该题的关键是明确燃烧热的概念,然后灵活运用即可。该题难度不大,学生极易得分。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《复合材料》.. | |