1、选择题 可用来鉴别甲烷和乙烯,又可用来除去甲烷混有的少量乙烯的是
[? ]
A.混合气通过成饱和食盐水的洗气瓶
B.混合气通过盛足量溴水的洗气皮瓶
C.混合气通过盛水的洗气瓶
D.混合气和氯化氢混合
参考答案:B
本题解析:
本题难度:一般
2、选择题 用NA表示阿伏加德罗常数的值.下列叙述中不正确的是
A.1L?0.5?mol?L-1的MgCl2溶液,含有Cl-数为?NA
B.标准状况下,11.2?L?CCl4中含有的分子数目为0.5NA
C.常温常压下,18?g?H2O中含有的原子总数为3NA
D.质量为32g的O3和O2的混合物中含有的氧原子数为2NA
参考答案:B
本题解析:分析:A.根据N(Cl-)=2n(MgCl2)VNA计算;
B.四氯化碳是液体;
C.1molH2O中含有的原子为3mol;
D.利用n=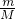 及O2和O3混合气体中分子都是只由氧原子构成来分析氧原子数.
及O2和O3混合气体中分子都是只由氧原子构成来分析氧原子数.
解答:A.N(Cl-)=2n(MgCl2) NA=2C(MgCl2)VNA=2×0.5mol?L-1×1L×NA=NA,故A正确;
B.四氯化碳是液体,标准状况下,11.2?L?CCl4的物质的量不是0.5mol,故B错误;
C.18?g?H2O的物质的量是1mol,含有的原子总数为3NA,故C正确;
D.因混合气体中分子都是只由氧原子构成,则氧原子的物质的量为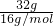 =2mol,氧原子数为2mol×NA=2NA,故D正确.
=2mol,氧原子数为2mol×NA=2NA,故D正确.
故选B.
点评:本题考查阿伏加德罗定律及其推论,题目难度中等,本题注意阿伏加德罗定律只适用于气体,另外在标准状况下,Vm=22.4L/mol,其它条件下也有可能为22.4L/moL.
本题难度:一般
3、实验题 (18分)铁、铝与冷浓硫酸可发生钝化现象,故工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)m g放入稀硫酸中,铁钉表面现象为?。取出铁钉用蒸馏水洗涤后干燥,置于冷浓硫酸中,10分钟后移入稀硫酸溶液中,观察,开始一段时间铁钉表面无明显变化,其原因是?。
(2)另称取铁钉放入足量冷浓硫酸中,加热,充分反应后,过滤得到、溶液X并收集到气体Y。
①甲同学认为X中除铁单质外外还可能含有Fe3+、Fe2+。若要确认其中的Fe2+,可选择试剂为_________________,现象是_______________________________________________。
②乙同学根据氧化还原反应原理,认为气体中必然含有SO2,取336ml(标准状况)气体Y通入足量溴水中,发生反应离子方程式为:________________________________________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为?。
[探究二]
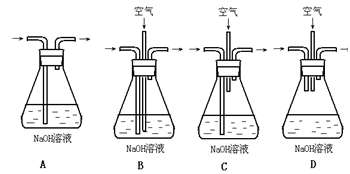
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)加以验证。
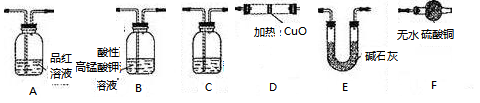
(3)装置的连接顺序是________________________________。
(4)除了C中的现象证明Q存在为,认为气体Y中还含有Q的理由是?(用化学方程式表示)。
(5)混合气体可能由H2、Q、SO2中的一种或多种气体组成,经测定其含氧量为50%,则该气体可能:①仅由SO2组成;②由H2和Q组成;③由H2和SO2组成;④由Q、SO2组成;⑤由H2、Q和SO2组成;其中可能正确的有( )
A.①
B.②③④
C.①②⑤
D.③④⑤
参考答案:
(1)有气泡冒出?铁钉表面被钝化(或其他合理答案)
(2)①酸性高锰酸钾溶液?酸性高锰酸钾溶液褪色 (或其他合理答案)?
②? SO2+Br2+H2O=4H++SO42-+2 Br -? 66.7%
(3)B A C E D F E?
(4)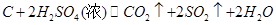
(5)c
本题解析:
(1)铁钉(碳素钢)放入冷浓硫酸中,浓硫酸有较强的氧化性能使铁钉表面形成一层致密的氧化保护膜,阻止内层铁的进一步发生反应。
(2)Fe2+能使酸性的高锰酸钾褪色,溶液中已经有Fe3+,选择碱会造成干扰,氢氧化铁红褐色的颜色影响无法辨别氢氧化亚铁的白色沉淀是否生成。
(3)品红可以检验A中是否完全除去SO2
(4)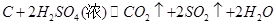
(5)经测定其含氧量为50%;氢气中不含氧元素;通过计算,CO2中氧元素的质量分数为72.7%,二氧化硫中氧元素的质量分数为50%.因此如果是一种物质就只能是二氧化硫,①可能正确;如果是两种物质,由H2和SO2组成时,小于50%,③不正确;只能是由H2和CO2组成,②可能正确;由CO2、SO2组成,大于50%,④不正确。由H2、CO2和SO2三种物质组成,⑤可能正确。故选C
本题难度:困难
4、选择题 下列有关除杂质(括号中为杂质)的操作中,错误的是
A.福尔马林(蚁酸):加入足量饱和碳酸钠溶液充分振荡,蒸馏,收集馏出物
B.乙醇(水):加入足量生石灰,蒸馏,收集馏出物
C.苯(苯酚):加溴水,振荡,过滤除去沉淀
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
参考答案:C
本题解析:A.蚁酸是有机酸,能与碳酸钠反映生成二氧化碳和蚁酸钠和水,福尔马林(甲醛溶液)中的溶质不与碳酸钠反应.甲醛易挥发,而盐类不挥发,所以用蒸馏法就能除杂,故A正确; B.乙醇中的水可通过加入足量生石灰除去,蒸馏得乙醇,B正确;C.苯中混有苯酚,加入溴水后生成可溶于苯的三溴苯酚,无法过滤除去,故C错误;D.乙酸乙酯在碳酸钠中的溶解度较小,乙酸和与碳酸钠反应生成乙酸钠水和二氧化碳,然后分液即可,故D正确。
本题难度:一般
5、填空题 (15分)工业中利用废铜(含有锌、铝等)制取硫酸铜,将适量硝酸分多次加入到铜粉与稀硫酸的混合物中加热,使之反应完全,通过蒸发、结晶得到硫酸铜晶体。
下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L—1计算)。
?
| 开始沉淀的pH
| 沉淀完全的pH
| 沉淀溶解的pH
|
Cu2+
| 4.4
| 6.4
| ?
|
Al3+
| 3.0
| 5.0
| 10
|
Zn2+
| 5.9
| 8.9
| 11
|
(1)①为了节约原料,硫酸和硝酸的物质的量之比最佳为??;该反应中产生尾气污染空气,请选择下图中合适的装置吸收尾气?。?
②由表可知Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2—,请写出金属锌与氢氧化钠溶液反应的离子方程式?
(2)为了符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:空气为氧化剂法
将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加入物质甲调节pH,铁元素全部沉淀(一般认为铁离子的浓度下降到10-5 mol·L-1,就认为沉淀完全。已知:Ksp[Fe((OH)3]≈10-38,然后过滤、浓缩、结晶。
请回答下列问题:
①方案为了使铁离子全部沉淀,应调节pH至少为??。
②方案中甲物质可选用的是??
A.CaO ? B.NaOH ? C.CuCO3 ? D.Cu2(OH) 2CO3?E.Fe2(SO4) 3
③方案中加入少量FeSO4可加速铜的氧化,用离子方程式解释其原因??。
第二组:过氧化氢为氧化剂法
将铜粉放到 1.5 mol·L-1的足量稀硫酸中,控温在50℃加入10%的足量H2O2反应0.5 h,升温到60℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 。
请回答下列问题:
④用过氧化氢为氧化剂法比流程中采用硝酸和硫酸溶解的优点是?。
⑤用少量95%的酒精淋洗的目的是??。
(3)废铜溶解后经过一系列操作得到硫酸铜溶液,补充完整由溶解液制备纯净硫酸铜溶液的实验步骤??。
参考答案:
(1) ①3∶2? B?
② Zn+2OH-+2H2O=[Zn(OH)4]2—+H2↑
(2)①3?
②CD ?
③4Fe2++O2+4H+===4Fe3++2H2O;2Fe3++Cu===2Fe2++Cu2+
④减少硫酸铜晶体的溶解损失
⑤ 产物是水,无污染?
(3)向溶液中加氢氧化钠溶液至pH为11,充分反应过滤洗涤,向沉淀中加适量稀硫酸溶解,制的硫酸铜溶液。
本题解析:(1)①铜与稀硫酸不反应,加入硝酸做氧化剂使铜溶解,反应为3Cu+3H2SO4+2HNO3=3CuSO4+2NO+4H2O,,由方程式知硫酸和硝酸的物质的量之比最佳为3:2;NO不能被氢氧化钠直接吸收,需先与氧气反应生成二氧化氮,在与氢氧化钠反应,故选B装置。②锌与强碱反应生成[Zn(OH)4]2—同时应生成氢气;(2)①根据Ksp[Fe((OH)3]计算,pH至少为3;②加入甲物质是使铁离子沉淀出来,同时不能引入新的杂质,加入不溶于水但与酸反应的铜的化合物,促进铁离子水解生成氢氧化铁沉淀而除去,故选用CuCO3、Cu2(OH) 2CO3 、CuO、Cu(OH)2等。③通入的氧气把亚铁离子氧化为铁离子,铁离子能与铜反应而使其溶解;④硫酸铜晶体溶于水,洗涤时需用饱和硫酸铜溶液或乙醇(盐不易溶解于有机溶剂),降低其溶解损失;⑤双氧水是绿色氧化剂,产物是水无污染;(3)根据信息可以根据铝、锌的氢氧化物溶解于强碱,调节pH得到氢氧化铜沉淀,然后加硫酸溶解制的硫酸铜溶液。
本题难度:困难