| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《水的电离平衡》试题强化练习(2019年最新版)(二)
参考答案:D 本题解析: 本题难度:简单 3、选择题 已知某温度下CH3COOH的电离常数K=1.6×10-5。该温度下向20 mL 0.01 mol/L CH3COOH溶液中逐滴加入0.01 mol/L KOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题: 参考答案:(1)4×10-4 mol·L-1 本题解析:(1)c(H+)= 本题难度:一般 4、选择题 将PH = 1的盐酸平均分成2份,1份加适量水,另一份加入与盐酸物质的量浓度相等的NaOH溶液后,PH均变成了2,则加入的水与NaOH溶液的体积比为 ( ) |
参考答案:C
本题解析:设每份盐酸的体积是V。稀释时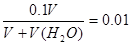 ,解得V(H2O)=9V。加氢氧化钠后,酸过量,则有
,解得V(H2O)=9V。加氢氧化钠后,酸过量,则有 ,解得V(NaOH)=9V/11。加入的水与NaOH溶液的体积比为11
,解得V(NaOH)=9V/11。加入的水与NaOH溶液的体积比为11
本题难度:一般
5、填空题 写出下列物质的电离方程式。
H2SO3______________________________,
NaHSO4(稀溶液)______________________________,
NaHSO4(熔融)______________________________。
参考答案:H2SO3=H++HSO3-;HSO3-=H++SO32-;
NaHSO4 (稀溶液)=Na++H++SO42-
NaHSO4 (熔融)=Na++HSO4-
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《物质结构与性质》.. | |