|
高考化学知识点整理《物质的组成》高频考点预测(2019年最新版)(六)
2020-08-13 07:12:32
【 大 中 小】
|
1、填空题 (15分)【化学---选修模块:物质结构与性质】
下表为周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于d区的元素是?(填编号)。
(2)元素⑥形成的最高价含氧酸根的立体构型是________,其中心原子的杂化轨道类型是_______。
(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是?。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.该氢化物分子中,②原子采用sp2杂化
| (4)某元素的特征电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为?;该元素与元素①形成的分子X构形为?;X在①与③形成的分子Y中的溶解度很大,其主要原因是?。
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为?(用对应的元素符号表示)。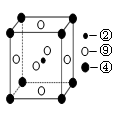
参考答案:(1)⑨?(1分)
(2)正四面体(2分)? SP3(2分)?(3)B、D(2分)
(4)3 (2分)?三角锥形(2分)?在NH3分子和水分子间有氢键作用(2分)
(5)MgNi3C?(2分)
本题解析:(1)区的名称来自按照构造原理最后通入电子轨道的能级名称,所以属于d区的是⑨,即镍元素。
(2)元素⑥是S,最高价氧化物的水化物是硫酸, SO42-硫原子的孤对电子是(6+2-2×4)÷2=0,即没有孤对电子,所以是正四面体,S原子是sp3杂化。
(3)产量作为衡量石油化工发展水平的标志是乙烯,乙烯分子中含有碳碳双键,但没有氢键、属于平面型结构,碳原子是sp2杂化。键角是120°,由于结构对称,所以是非极性分子。双键是由1个σ键和1个π键构成的,所以分子中含有5个σ键和1个π键,因此正确但答案选BD。
(4)根据核外电子的排布规律可知,s能级只能容纳2个电子,素n=2,即该元素是氮元素,核外最外层电子的孤对电子数为3。和氢元素形成氨气,是三角锥形结构。①与③形成的分子是水,由于在NH3分子和水分子间有氢键,且二者都是极性分子,所以氨气极易溶于水。
(4)④是镁,位于顶点,所以含有的原子个数是8×1/8=1,⑨是镍,位于面心处,含有6×1/2=3个。碳原子在中间,所以化学式为MgNi3C。
本题难度:一般
2、填空题 (13分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
10电子粒子
| CH4、NH3、H2O、HF、Na+、Al3+、NH4 +、OH-
| 18电子粒子
| H2S、HCl、K+ 、Cl-、C2H6?……
|
?
(1)表中-1价的简单离子在周期表中的位置是?(周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为?
(2)表中水溶液显碱性的分子的电子式是?
写出其催化氧化的化学方程式?
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
?。
(4)表中在水溶液中能够促进水电离的粒子有?
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。

其中操作有错误的单元有(选填①②……)?
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式?
参考答案:(13分)
(1)(3分,其中方程式2分,下同)?第三周期ⅦA? Cl2+2OH-==Cl-+ClO-+H2O
(2)(3分) NH3电子式略? 4NH3+5O2==4NO↑+6H2O
(3)(2分) NH4 + + H2O="=" NH3↑ + H2O
(4)(1分,只答对一个不给分) Al3+、NH4 +?
(5)(2分,其中答对两个给1分,错答不给分)①③④⑤
(6)(2分)N2H4(l) + 2H2O2(l) = 4H2O(l) + N2(g)? ΔH=﹣1676kJ/m
本题解析:略
本题难度:简单
3、选择题 在国庆60周年阅兵式上,展示了我国研制的各种导弹。导弹之所以有神奇的命中率,是制导弹合金材料中的稀土元素钕(60Nd)的贡献。下列说法正确的
A.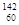 Nd、 Nd、 Nd 和 Nd 和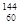 Nd 互为同素异形体 Nd 互为同素异形体
B.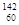 Nd 、 Nd 、 Nd 和 Nd 和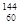 Nd 的化学性质不同 Nd 的化学性质不同
C.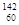 Nd 原子中含有60个质子和142个中子 Nd 原子中含有60个质子和142个中子
D.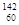 Nd、 Nd、 Nd和 Nd和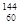 Nd都是钕元素的不同核素 Nd都是钕元素的不同核素
参考答案:D
本题解析:同素异形体是化合物,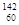 Nd、 Nd、 Nd 和 Nd 和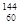 Nd 表示核素,故A错误;元素的化学性质与原子的最外层电子有关, Nd 表示核素,故A错误;元素的化学性质与原子的最外层电子有关,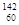 Nd 、 Nd 、 Nd 和 Nd 和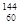 Nd三种原子中电子数相同,最外层电子数相同,所以化学性质相同,故B错误; Nd三种原子中电子数相同,最外层电子数相同,所以化学性质相同,故B错误;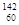 Nd 原子中含有60个质子和82个中子,故C错误; Nd 原子中含有60个质子和82个中子,故C错误;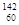 Nd、 Nd、 Nd和 Nd和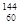 Nd都是钕元素的不同核素,故D正确,为本题的答案。 Nd都是钕元素的不同核素,故D正确,为本题的答案。
点评:本题考查了常见的化学用语,该考点是高考常考的考点,本题难度适中。
本题难度:一般
4、填空题 (16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题:
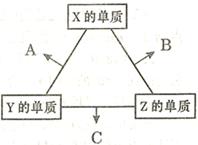 ? ?
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物的化学式为?,相同浓度上述水溶液中由水电离出的c(H+)最小的是?(填写化学式)。
(2)Allis-Chalmers制造公司发现可以用C作为燃料电池的燃料,以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,试写出该电池负极的电极反应式?,溶液中OH-向?极移动(填“正”或“负”)。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,该反应的化学方程式为?。
②将铜粉末用10%甲和3.0mol?L-1H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
| 铜的平均溶解速率
(×10-3mol?L-1·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是?
_____________________________________________________。
③实验室可用甲作试剂取X的单质,发生装置可选用下图中的?(填装置代号)。
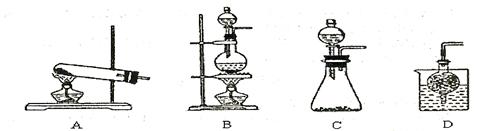
参考答案:(1)HNO3、NH4NO3、NH3·H2O (3分)? HNO3?(1分)
(2)4NH3 + 12OH - 12e- =2N2 + 12H2O?(3分)?负(2分)
(3)①N2H4 + 4CuO = N2↑ + 2Cu2O + 2H2O(3分)
②高于40℃后,H2O2的分解速率加快,c(H2O2)降低,使铜的溶解速率减慢 (2分) ③C (2分)
本题解析:X、Y、Z三种短周期元素,其单质在常温下均为无色气体,短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),H、N、O原子序数之和为16,故三种元素为H、N、O,三种气体单质相互反应生成H2O、NH3、NO,一个B分子中含有的Z元素的原子个数比一个C分子中少一个,则B为H2O,C为NH3,Z为氢元素.由关系图可知:Z单质与X单质反应生成B(H2O),故X为氧元素;Z单质与Y单质反应生成C(NH3),故Y为氮元素;所以A为NO,则:
(1)由 X、Y、Z三种元素共同组成的三种不同种类的常见化合物一般是酸碱盐,因此化学式分别为HNO3、NH4NO3、NH3·H2O。硝酸和氨水抑制水的电离,硝酸铵水解促进水的电离。硝酸是一元强酸,氨水是一元弱碱,因此相同浓度上述水溶液中由水电离出的c(H+)最小的是HNO3。
(2)原电池中负极失去电子,正极得到电子,因此在该燃料电池中氨气在负极通入,若以氢氧化钾溶液为介质,反应生成对环境无污染的常见物质,该物质应该是氮气和水,因此该电池负极的电极反应式4NH3 + 12OH - 12e- =2N2 + 12H2O。原电池中阳离子向正极移动,阴离子向负极移动,所以溶液中OH-向负极移动。
(3)Z分别与X、Y两元素可以构成18个电子分子甲和乙,其分子中只存在共价单键,常温下甲、乙均为无色液体,甲随着温度升高分解速率加快,所以甲是双氧水,乙是N2H4。
①乙能够将CuO还原为Cu2O,已知每lmol乙参加反应有4mole- 转移,由于N2H4中氮元素的化合价是-2价,这说明在反应中氮元素化合价升高2个单位,因此其氧化产物是氮气,所以该反应的化学方程式为N2H4 + 4CuO = N2↑ + 2Cu2O + 2H2O。
②由于双氧水不稳定,受热易分解,因此高于40℃后,H2O2的分解速率加快,c(H2O2)降低,使铜的溶解速率减慢。
③在催化剂的作用下双氧水分解生成氧气和水,反应不需要加热,因此选择装置是C。
本题难度:一般
5、选择题 下列叙述不正确的是?(?)
A.H2S、H2O、HF的稳定性依次增强
B.RbOH、KOH、Mg(OH)2的碱性依次减弱
C.Na+、Mg2+、Al3+的氧化性依次减弱
D.H4SiO4、H2CO3、H2SO4酸性依次增强
参考答案:C
本题解析:非金属性越强,氢化物的稳定性越强,A正确;非金属性或金属性越强,最高价氧化物的水化物的酸性或碱性越强,则选项BD正确;金属性越强,相应金属阳离子的氧化性越弱,则选项C不正确, Na+、Mg2+、Al3+的氧化性应该是依次增强,答案选C。
点评:该题是高考中的常见考点,属于中等难度试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练,旨在考查学生灵活运用元素周期律知识解决实际问题的能力。该题的关键是明元素周期律的含义,然后结合题意灵活运用即可。
本题难度:简单
| 

