| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的组成》高频考点预测(2019年最新版)(五)
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为?(用对应的元素符号表示)。 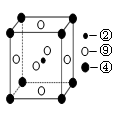 2、填空题 (13分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
(1)表中-1价的简单离子在周期表中的位置是?(周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为? (2)表中水溶液显碱性的分子的电子式是? 写出其催化氧化的化学方程式? (3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式 ?。 (4)表中在水溶液中能够促进水电离的粒子有? (5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。  其中操作有错误的单元有(选填①②……)? (6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式? 3、选择题 在国庆60周年阅兵式上,展示了我国研制的各种导弹。导弹之所以有神奇的命中率,是制导弹合金材料中的稀土元素钕(60Nd)的贡献。下列说法正确的 4、填空题 (16分)X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16。在适当条件下三种单质两两化合,可发生如右图所示变化。己知l个B分子中含有Z元素的原子个数比C分子中含有Z元素的原子个数少1个。请回答下列问题:
_____________________________________________________。 ③实验室可用甲作试剂取X的单质,发生装置可选用下图中的?(填装置代号)。 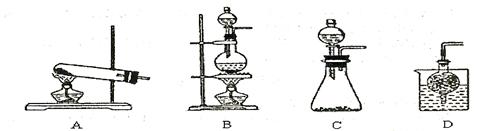 5、选择题 下列叙述不正确的是?(?) |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《硝酸》答题技巧(2.. | |