1、填空题 (4分)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是 (填代号)。
A.一定增大 B.一定减小 C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当? (填“是”或“否”),理由是 。
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有 。(多选)
A.NaOH
B.氨水
C.Cu2(OH)2CO3
D.Na2CO3
E.CuO
F.Cu(OH)2
参考答案:(4分)(1)① A ② 否 , 会引入新杂志Na+,造成产品不纯。(2) CEF
本题解析:(1)①NaClO在酸性条件下与Fe2+的反应是:2Fe2++ClO-+2H+=2Fe3++Cl-+H2O,由于反应过程中要消耗H+,溶液pH一定升高,选A;②NaClO可以将Fe2+氧化成Fe3+,但引入了新杂质Na+,实际上不能采用,必须应用既能氧化Fe2+又不能引入新杂质的氧化剂,例如Cl2、O2、H2O2等,答案为否 , 会引入新杂志Na+,造成产品不纯;(2)同理,调整pH所选用的试剂可以是CuO、Cu2(OH)2CO3、Cu(OH)2等不会引入新杂质的物质,选CEF。
考点:考查盐的水解,离子除杂等知识。
本题难度:一般
2、选择题 下述根据下列操作和现象,所得结论正确的是
| 实验操作及现象
| 实验结论
|
A
| 分别向2mL0.1mol·L-1CH3COOH溶液和2mL0.1mol·L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象
| 酸性:CH3COOH>H2CO3>H3BO3
|
B
| 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀
| 溶度积:Ksp(AgCl)<Ksp(AgI)
|
C
| 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去
| 证明生成了乙烯
|
D
| 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色
| 氧化性:Br2>I2
|
参考答案:AD
本题解析:A、根据复分解反应的规律:强酸制弱酸的原理,醋酸与碳酸氢钠溶液反应生成二氧化碳,说明醋酸酸性大于碳酸,而H3BO3与碳酸氢钠溶液混合,无气体产生,说明酸性H2CO3>H3BO3,正确;B、向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明AgI比AgCl更难溶,则Ksp(AgCl)>Ksp(AgI),错误;C、向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去,不能说明生成了乙烯,因为乙醇易挥发,且乙醇也能使酸性高锰酸钾溶液褪色,错误;D、将少量的溴水滴入NaI溶液中,则生成碘单质和NaBr,再滴加CCl4,碘在四氯化碳中的溶解度大于在水中的溶解度,且四氯化碳的密度大于水与水不互溶,在下层,所以振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色,正确,答案选AD。
考点:考查反应的原理判断,现象与结论的分析正误判断的知识。
本题难度:困难
3、选择题 已知:CaC2O4沉淀的Ksp=2.3×10-9,将等体积的CaCl2溶液与Na2C2O4溶液混合,若起始CaCl2的浓度为1×10-2mo1?L-1,则生成沉淀所需Na2C2O4溶液的最小起始浓度为( )
A.2.3×10-7mol?L-1
B.4.6×10-7mol?L-1
C.9.2×10-7mol?L-1
D.
×10-3mol?L-1
参考答案:CaCl2溶液的浓度为1×10-2mo1/L,等体积混合后浓度为5×10-3mo1/L,
由Ksp(CaC2O4)=c(C2O42-)×c(Ca2+)可知,混合后c(C2O42-)=KspC(Ca2+)=2.3×10-95×10-3=4.6×10-7mol?L-1
所以所需Na2C2O4溶液的最小起始浓度为4.6×10-7mol?L-1×2=9.2×10-7mo1/L;
故选C.
本题解析:
本题难度:简单
4、选择题 下表列出了几种常见物质的电离常数或溶度积

在一定量的0.2 mol/L CaCl2溶液中加入等体积的下列溶液,可以产生沉淀的是
[? ]
A.由水电离出的c(H+) =10-9mol/L的HF溶液
B.pH=10的氨水
C.1 mol/L的NaHCO3溶液
D.10-9 mol/L的AgNO3溶液
参考答案:C
本题解析:
本题难度:一般
5、填空题 炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉(Cd)是一个有益的尝试,其流程如下:
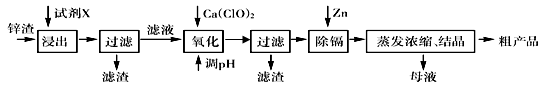
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7。试回答下列问题:
(1)浸出时用到的试剂X为?, 写出溶解过程中加快浸出速率和提高浸出率的两点措施:_______________________________,______________________________。
(2)写出加入Ca(ClO)2反应的离子方程式?。
(3)调节pH过程可以选用?(填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是??。
(4)写出过滤后加入过量的锌粉反应的离子方程式?。
(5)在蒸发浓缩操作时,要采取实验措施是:?。
参考答案:(1)H2SO4溶液?适当升温、充分搅拌、延长溶解时间等(其它答案合理也给分)
(2)2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O(配平错扣1分)
(3)ZnO ,除去Fe3+和Al3+,防止Zn2+沉淀析出
(4)Zn+Cd2+=Zn2++Cd?(5)保持一定的酸度(其它表达合理也给分)
本题解析:(1)本题是制备硫酸锌晶体的的工艺流程,锌渣中含有难溶的二氧化硅杂质,选用酸溶除去二氧化硅,考虑尽量少引入杂质,应选含有硫酸根离子的硫酸溶液进行溶解。若要加快浸出速率和提高浸出率,可以适当升高温度或搅拌溶液或适当延长时间等。
(2)用硫酸浸出的滤液中含有少量Fe3+、Al3+、Zn2+、Cd2+、Fe2+ 等离子,考虑这些离子分别沉淀的pH值,应该把Fe2+ 氧化为Fe3+ 在沉淀除去,所以加入氧化剂Ca(ClO)2 发生的反应方式为:2H++ClO—+2Fe2+ =Cl—+2Fe3++H2O。
(3)由于整个流程制备的是硫酸锌晶体,所以在调节pH时要注意不能引入杂质,所以应该选用ZnO调节,而调节pH值到5左右目的是使容易沉淀的Fe3+、Al3+ 先沉淀除去,防止pH过高把生成的Al(OH)3溶解、把Zn2+ 沉淀。
(4)在上步调节完pH后,溶液中还存在杂质离子Cd2+ ,由于Cd2+ 沉淀的pH值与Zn2+ 沉淀的pH值相近,所以不能用沉淀法除去,所以要加入单质Zn把Cd置换出来,因此发生的离子方程式为:Zn+Cd2+=Zn2++Cd。
(5)硫酸锌在蒸发浓缩时容易发生水解,所以为了减少水解产生杂质,应该保持溶液一定的酸度。
本题难度:困难