1、选择题 下列表述中,不正确的是
A.用稀盐酸洗涤AgCl沉淀比用水洗涤,损耗AgCl少
B.等体积的 pH均等于3的盐酸和AlCl3溶液中,已电离的水分子数前者一定小于后者
C.高效催化剂可使水分解,同时释放能量
D.明矾用于净水和氯气用于自来水的杀菌消毒,两个反应遵循的化学原理不同
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列说法不正确的是(?)
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的溶解度一定小
参考答案:D
本题解析:两种难溶电解质作比较时,结构相同的,Ksp小的溶解度一定小。不同的无可比性。故D项错误。
本题难度:一般
3、填空题 (7分)(1)现有反应:CO(g)+H2O(g)? CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向? ?方向进行。?
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是? ?。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a? b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为?。
参考答案:(7分,除标注外每空2分)?
(1)①逆反应(1分)?②0 ≤ x<3.0?③小于?(2)5.6×10—5mo1/L
本题解析:略
本题难度:一般
4、填空题 (8分)硫酸镁在医疗上具有镇静、抗挛等功效。以菱镁矿(主要成分是MgCO3)为主要原料制备硫酸镁的方法如下:
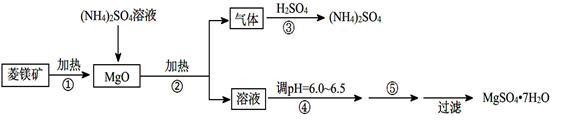
(1)步骤②中发生反应的离子方程式为 。
(2)步骤④中调节pH=6.0~6.5的目的是 。
(3)步骤⑤的操作为
(4)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH
| < 8.0
| 8.0 ~ 9.6
| > 9.6
|
颜色
| 黄色
| 绿色
| 蓝色
|
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色
为 [25℃时,Ksp[Mg(OH)2] =5.6×10-12]。
参考答案:(8分)
(1)2NH4+ + MgO=Mg2+ + 2NH3↑+ H2O (2分)
(2)抑制Mg2+水解,以便得到更多更纯的产品 (2分)
(3)蒸发浓缩,冷却结晶(2分)
(4)蓝色(2分)
本题解析:(1)MgO与硫酸铵溶液加热反应生成的气体与硫酸反应生成硫酸铵,说明该气体是氨气,则MgO与硫酸铵加热的产物中有氨气,说明MgO的加入,促进铵根离子的水解,生成氨气,得到的氢离子与MgO反应生成镁离子和水,所以步骤②中发生反应的离子方程式为2NH4+ + MgO=Mg2+ + 2NH3↑+ H2O;
(2)得到的硫酸镁溶液中镁离子水解,得不到较纯的硫酸镁晶体所以为抑制镁离子水解,步骤④中调节pH=6.0~6.5,以便得到更多更纯的产品;
(3)由溶液得到晶体需进行的操作是蒸发浓缩、冷却结晶,所以步骤⑤的操作为蒸发浓缩,冷却结晶;
(4)饱和的氢氧化镁溶液存在Mg(OH)2 (s)= Mg2+(aq) + 2 OH-(aq)溶解平衡,2c(Mg2+)= c(OH -),又溶度积Ksp= c(Mg2+)c2(OH -)=5.6×10-12 ,由此可以得出c(OH -)=2.24×10-4 ,c(H+)=1×10-14/2.24×10-4 =4.5×10-11,所以pH>9.6,所以加入百里酚蓝指示剂,溶液呈蓝色。
考点:查了镁及其化合物性质的应用,对工业流程的分析,操作步骤的判断,溶度积的计算
本题难度:一般
5、选择题 某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示.该温度下,下列说法正确的是( )
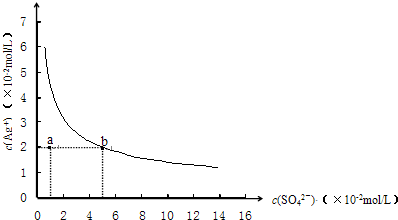
A.含有大量SO42-的溶液中肯定不存在Ag+
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
参考答案:A.Ag2SO4在水中沉淀溶解平衡为:Ag2SO4(s)?2Ag+(aq)+SO42-(aq),溶解为可逆过程,溶液中一定存在Ag+,故A错误;
B.0.02mol/L的AgNO3溶液与0.2mol/L的Na2SO4溶液等体积混合,c(SO42-)=0.1mol/L时,c(Ag+)=0.01mol/L,c2(Ag+)×c(SO42-)=1×10-5<ksp,不会生成沉淀,故B正确;
C.由图象可知,当c(SO42-)=5×10-2mol/L时,c(Ag+)=2×10-2mol/L,则ksp=c2(Ag+)×c(SO42-)=2×10-5,故C错误;
D.加热蒸发时,溶液中银离子和硫酸根离子浓度都增大,故D错误.
故选B.
本题解析:
本题难度:一般