1、计算题 将质量为11.5 g钠和一定量的铝混合放入水中,充分反应共收集到12.32 L气体(标准状况),若反应后溶液的体积为1000 mL,则溶液中所有溶质的物质的量浓度为多少?(写出计算过程)
参考答案:NaOH:0.3mol/L? NaAlO2:0.2 mol/L
本题解析:12.32 L气体(标准状况)的物质的量=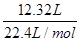 =0.55mol
=0.55mol
11.5g钠的物质的量=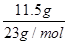 =0.5mol
=0.5mol
根据反应的方程式可知
2Na+2H2O=H2↑+2NaOH
2?1 ?2
0.5mol? 0.25mol? 0.5mol
这说明铝与氢氧化钠反应生成的氢气物质的量=0.55mol-0.25mol=0.3mol
则根据方程式可知
2Al?+2OH-+2H2O=2AlO2-+3H2↑
2? 2? 2? 3
0.2mol? 0.2mol? 0.2mol? 0.3mol
所以反应后氢氧化钠过量,溶液中剩余氢氧化钠的物质的量=0.5mol-0.2mol=0.3mol
NaAlO2的物质的量=0.2 mol/L
本题难度:一般
2、选择题 金属钠在空气中久置后变质为(?)
A.NaOH
B.Na2O
C.Na2O2
D.Na2CO3
参考答案:D
本题解析:钠与空气中氧气极易反应,致使钠表面变暗,氧化钠与空气中的水蒸气反应生成白色固体氢氧化钠,氢氧化钠易潮解表面变成溶液,氢氧化钠是强碱与空气中的酸性气体反应,生成白色带结晶水的固体Na2CO3.10H2O,十水碳酸钠易风化生成白色粉末碳酸钠,所以最终产物为Na2CO3,
故选A。
点评:本题考查钠及其化合物的性质,根据现象反应出本质,有什么样的变化就应该有什么样的现象。
本题难度:一般
3、填空题 某实验小组欲探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签。于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究。
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊。A受热分解的化学方程式为?。
(2)称取两种固体各2 g,分别加入两个小烧杯中,再各加10 mL 蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复至室温,向所得溶液中各滴入2滴酚酞溶液。
①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论?。
②同学们在两烧杯中还观察到以下现象。其中,盛放Na2CO3的烧杯中出现的现象是
?(填字母序号)。
a.溶液温度下降? b.溶液温度升高
c.滴入酚酞后呈无色? d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置I和II中分别放入药品,将气球内的固体同时倒入试管中。

①两试管中均产生气体,?(填“I”或“II”)的反应程度更为剧烈。
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是?。
a.装置I的气球体积较大? b.装置II的气球体积较大
c.生成气体的体积根据盐酸计算? d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5 mol·L-1的溶液,设计如下方案并对反应现象做出预测:
实验方案
| 预测现象
| 预测依据
|
操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
| 有白色沉淀
| Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2+ + CO32- = CaCO3↓。
|
操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液
| 无白色沉淀
| NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应。
|
?
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为?。
参考答案:(1)2NaHCO3 Na2CO3+ CO2↑+H2O.
Na2CO3+ CO2↑+H2O.
(2)①在相同的温度下,Na2CO3比NaHCO3容易溶解于水中。?② b d?
(3)①Ⅰ?② a (4)Ca2++2HCO3-= CaCO3↓+ CO2↑+H2O.
本题解析:(1)根据题意可知A是NaHCO3;B是Na2CO3。A受热分解的化学方程式为2NaHCO3 Na2CO3+ CO2↑+H2O. (2) ①根据实验现象得到的结论是:在相同的温度下,Na2CO3比NaHCO3容易溶解于水中。②盛放Na2CO3的烧杯中出现的现象是b.溶液温度升高 。d.滴入酚酞后呈红色。所以选项为:b d. (3) Na2CO3与盐酸反应分步进行。首先是HCl+Na2CO3=NaHCO3 +NaCl;不产生气体。然后是HCl+ NaHCO3 =" NaCl+" CO2↑+H2O.所以Ⅰ比Ⅱ反应的放出气体要快。即Ⅰ程度更为剧烈。② 根据计算可知①NaHCO3 +HCl= CO2↑+H2O +NaCl 产生气体按照NaHCO3计算。②2HCl+Na2CO3= CO2↑+H2O +2NaCl.放出气体反应放出气体按照HCl来计算。当盐酸相同时NaHCO3反应产生的气体多。所以选项为:a.(4) 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液,产生白色沉淀和气体。是因为HCO3-在溶液中既存在电离 也存在着水解平衡,电离产生的碳酸根离子与钙离子结合形成碳酸钙沉淀。水解产生的碳酸达到一定量就发生分解反应产生二氧化碳和水。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为: Ca2++2HCO3-= CaCO3↓+ CO2↑+H2O.2CO3和NaHCO3的性质的知识。
Na2CO3+ CO2↑+H2O. (2) ①根据实验现象得到的结论是:在相同的温度下,Na2CO3比NaHCO3容易溶解于水中。②盛放Na2CO3的烧杯中出现的现象是b.溶液温度升高 。d.滴入酚酞后呈红色。所以选项为:b d. (3) Na2CO3与盐酸反应分步进行。首先是HCl+Na2CO3=NaHCO3 +NaCl;不产生气体。然后是HCl+ NaHCO3 =" NaCl+" CO2↑+H2O.所以Ⅰ比Ⅱ反应的放出气体要快。即Ⅰ程度更为剧烈。② 根据计算可知①NaHCO3 +HCl= CO2↑+H2O +NaCl 产生气体按照NaHCO3计算。②2HCl+Na2CO3= CO2↑+H2O +2NaCl.放出气体反应放出气体按照HCl来计算。当盐酸相同时NaHCO3反应产生的气体多。所以选项为:a.(4) 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol·L-1CaCl2溶液,产生白色沉淀和气体。是因为HCO3-在溶液中既存在电离 也存在着水解平衡,电离产生的碳酸根离子与钙离子结合形成碳酸钙沉淀。水解产生的碳酸达到一定量就发生分解反应产生二氧化碳和水。则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为: Ca2++2HCO3-= CaCO3↓+ CO2↑+H2O.2CO3和NaHCO3的性质的知识。
本题难度:一般
4、选择题 将1.15 g钠和0.4 g硫粉迅速混合,并放在石棉网上加热,反应后的固体可能是(?)
A.硫与硫化钠
B.氧化钠与硫化钠
C.过氧化钠与硫化钠
D.硫化钠
参考答案:C
本题解析:硫与钠反应的化学方程式为S+2Na====Na2S,从方程式可得钠与硫反应时的质量比是46∶32,1.15 g钠需要0.8 g硫,现只有0.4 g硫,金属钠过量。过量的金属钠在空气中燃烧生成过氧化钠,所以产物有硫化钠和过氧化钠。
本题难度:简单
5、填空题 (1)用金属钠制取过氧化钠的化学方程式为________________________。
(2)用金属钠制取氧化钠通常利用反应2NaNO2+6Na=4Na2O+N2↑,而不采用钠在氧气中燃烧的方法,采用此法的原因是__________,该反应中氧化剂是__________,还原剂是________________。
(3)制氧化亚铁常利用该反应试说明不采用FeCO3加热分解制FeO而用此法制FeO的原因:____________________________________。
参考答案:(1)
(2)此法在N2环境中,Na2O不会被继续氧化为Na2O2,而钠在氧气中燃烧生成Na2O2 NaNO2 Na
(3)FeCO3在空气中加热,+2价铁易被空气氧化成+3价,从而得不到FeO。用FeC2O4加热分解,在CO气流中可防止FeO被氧化
本题解析:
本题难度:一般