1、实验题 Na2CO3是一种很重要的化学物质,某学生拟在实验室中制备Na2CO3。下面是他的制备实验过程:用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入的CO2气体过量,生成NaHCO3,他设计了如下实验步骤:
(I)用25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
(Ⅱ)小心煮沸溶液1~2分钟;
(Ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合。
(1)在(I)中,刚通入CO2时发生的反应化学方程为?而后又发生反应的离子方程式为?
在(Ⅱ)中煮沸溶液的目的是?
在(Ⅲ)中混合另一半NaOH溶液后发生的反应的离子方程式是?。
(2)按该同学的设计,第(I)步实验装置如下:

①装置A使用的试剂是?(固体)和?;
②装置B使用的试剂最好是?(选择:水、饱和NaOH溶液、饱和Na2CO3溶液、饱和NaHCO3溶液),作用是?,如果不用B装置,最终得到的Na2CO3溶液中可能存在的杂质有?。
2、选择题 下列有关Na2CO3和NaHCO3的说法,错误的是
A.都易溶于水
B.水溶液都显碱性
C.都能与盐酸反应
D.加热都能分解
3、填空题 三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C。已知A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W。据此回答:
(1)Y是??(填元素名称)
(2)向C的水溶液中滴入紫色石蕊试液充分振荡后石蕊试液褪色,说明C具有?性。
(3)化合物B的电子式为??
(4)写出A与水反应的化学方程式??
4、选择题 下列对碱金属性质的叙述中,正确的是(? )
A.都是银白色的质软金属,密度都很小
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质与水剧烈反应生成碱和H2
D.单质熔沸点随着原子序数的增加而升高
5、实验题 某兴趣小组为测定某工业纯碱(假设仅含NaHCO3杂质)中Na2CO3的质量分数,设计了下列四种实验方案:
方案一:纯碱样品 测定剩余固体质量
测定剩余固体质量
(1)称取mg样品放入坩埚中充分加热。坩埚中发生反应的化学方程式为:?
(2)将坩埚置于干燥器中冷却后称量。实验时需要重复“加热、冷却、称量”操作多次,其目的是:?。
方案二:称取mg样品配成250mL溶液,从中取25mL溶液先用酚酞作指示剂用0.1mol/LHCl溶液滴定至终点,消耗0.1mol/LHCl溶液V1mL,继续用甲基橙作指示剂滴定至终点,消耗0.1mol/LHCl溶液V2mL。则该样品中碳酸钠的质量分数为:??。
方案三:纯碱样品溶液 测定沉淀质量
测定沉淀质量
(1)称取m1g样品,置于小烧杯中,加水溶解后滴加足量氯化钙溶液。将反应混和物过滤后的下一步操作是:?,沉淀经干燥后称量为m2g。
(2)如果用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,_______测定样品中的Na2CO3的质量分数。(填“能”或“不能”)
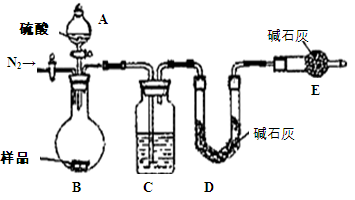
方案四:纯碱样品 测定生成二氧化碳的质量
测定生成二氧化碳的质量
(1)本实验采用如图装置,C中盛放的物质是?。
(2)反应前后都要通入N2,反应后通入N2的目的是:?