1、实验题 一定量的浓硫酸与足量Zn充分反应时,有SO2和H2生成.某校化学研究性学习小组对此进行研究.按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又会明显增加.

试回答:
(1)装置A中需用浓H2SO4,用一种简单的方法确定一瓶H2SO4一定是浓H2SO4:
________________________________________________________________________.
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接__________、________接b,c接________、____________接d;D、E两支试管中CCl4溶液的作用是_____________________________________________________________________.
(3)能证明浓硫酸具有强氧化性的实验现象为_____________________________;
反应较长时间后气泡量又会明显增加的原因是___________________________
(4)D中浑浊消失的离子方程式为____________________________________
参考答案:(1)用火柴梗蘸取少量H2SO4,火柴梗若立即变黑,证明是浓H2SO4;用滴管吸取少量H2SO4,滴加在盛少量水的试管中,若试管发热,则证明是浓H2SO4
(2)3或4 4或3 1 2 防倒吸
(3)C中品红溶液褪色 浓H2SO4变成稀H2SO4,与Zn反应放出H2
(4)SO2+H2O+CaSO3===Ca2++2HSO
本题解析:(1)浓硫酸和稀硫酸的区别主要是体现在浓硫酸的三大特性上,即吸水性、脱水性和强氧化性。另外浓硫酸溶于水会放出大量的热,据此也可以进行鉴别。
(2)因为二氧化硫易溶于水,所以为了防止倒吸需先选择乙装置,然后才是甲装置。
(3)若浓硫酸具有强氧化性,则反应中生成的气体应是二氧化硫而不是氢气,所以品红溶液会褪色。随着反应的进行,硫酸的浓度会变稀,达到一定程度就会生成氢气。
(4)石灰水变混浊是因为生成了难溶于水的亚硫酸钙,但当二氧化硫过量时,亚硫酸钙会继续和二氧化硫反应生成可溶的亚硫酸氢钙。
本题难度:一般
2、选择题 X、Y、Z、W有如图所示的转化关系,则X、Y可能是(?)

①C、CO;②AlCl3、Al(OH)3;③N2、NO;④S、SO2;⑤NaOH、Na2CO3
A.①②⑤? B.②③⑤? C.③④?D.①②④
参考答案:A
本题解析:①转化关系为C→CO→CO2,C→CO2,故①正确;②转化关系为AlCl3→Al(OH)3→NaAlO2,AlCl3→NaAlO2,故②正确;③N2与O2反应生成NO,NO与O2反应生成NO2,N2不能一步反应生成NO2,故③错误;④二氧化硫在催化剂条件下生成三氧化硫,单质硫不能一步反应生成三氧化硫,故④错误;⑤转化关系为NaOH→Na2CO3→NaHCO3,NaOH→NaHCO3,故⑤正确。
本题难度:一般
3、选择题 两份质量均为a g的硫,在一定条件下分别跟足量的氢气和氧气完全反应,反应后将生成物混合,析出硫的质量为(?)
A.2a g
B.a g
C.1.5a g
D.0.5a g
参考答案:C
本题解析:先写出硫分别跟足量的氢气和氧气反应的化学方程式,分别求出生成H2S和SO2的质量,再根据H2S和SO2的反应的比例关系,确定H2S和SO2哪种物质过量,最后根据方程式中不过量的物质和析出硫的比例关系求出析出硫的质量。
本题难度:简单
4、实验题 (12分)某化学兴趣小组为了探究锌与浓硫酸反应生成气体的成分做了如下实验:
将50g锌粉与50mL浓H2SO4在加热条件下充分反应,锌粉有剩余,收集到一定体积的气体,将该气体体积折算成标准状况为11.2L。
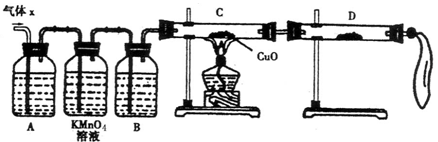
(1)化学兴趣小组所制得的气体X中混有的主要杂质气体可能是
(填分子式)。产生这种结果的主要原因是(用离子方程式表示) 。
(2)实验验证:为了检验主要杂质气体的成分,化学兴趣小组的同学设计了如下实验,对气体X取样进行探究。
①A中加入的试剂可能是 ,作用是 。
B中加入的试剂可能是 。
②证实气体X中混有杂质气体,D中应选择的试剂是 ,同时应观察到C中的实验现象是 。
(3)理论分析:
①该小组有同学提出只需要再测出一个数据,便能准确的确定该气体的组成,你认为他可以是测下列?。
A、反应后剩余锌的质量为17.5g
B、收集到气体的质量为25.8g
C、浓硫酸的物质的量浓度为18.0mol/L
②根据你在①中所选数据,通过计算确定气体X中各成分物质的量分别为: 。
参考答案:(12分)
(1)H2 Zn+2H+=Zn2++H2↑(2分)
(2)①NaOH溶液(或其他合理答案) ,吸收SO2气体,浓H2SO4
②无水CuSO4,黑色固体变红
(3)①BC ②SO2为0.4mol,H2为0.1mol
本题解析:锌与浓硫酸可生成SO2气体:①Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
当浓硫酸逐渐变为稀硫酸时,生成H2:②Zn+H2SO4(稀)=ZnSO4+H2↑
(1)可见所谓有杂质气体就是氢气
(2)为了检验氢气的存在,结合题目所给装置及药品可知:用氢气还原CuO(黑色粉末变红),生成的水用无水硫酸铜(装置D)来检验
先用碱液吸收SO2,再通过KMnO4溶液是否褪色来检验并再次吸收SO2;随后必须用浓硫酸干燥气体,得到干燥纯净的氢气,通入装置C中来还原CuO;
(3)设混合气体中SO2、H2的物质的量分别为x mol、y mol
由①②两方程式及题目所给数据可知,确定该混合气体(SO2、H2)的组成,已经知道混合气体的体积(标准状况下x+y=11.2/22.4=0.5),只要知道收集到气体的质量或浓硫酸的物质的量浓度均可再列出一等式,即可满足题意
64x+2y=25.8或2x+y=0.05×18
但知道反应后剩余锌粉的质量只能列出同样的等式,即:x+y=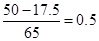 ,求不出未适量,排除A
,求不出未适量,排除A
故答案为BC
最终解得:x=0.4mol? y=0.1mol
本题难度:一般
5、填空题 铜与浓硫酸发生反应的化学方程式为:Cu+2 H2SO4(浓)?△?CuSO4+ SO2↑ + 2 H2O,其中铜元素的化合价?(填“升高”或“降低”),被?(填“氧化”或“还原”,下同),浓H2SO4作?剂;在该反应中,若消耗了0.5 mol Cu,则标准状况下生成SO2的体积约为?L。
参考答案:27、升高?氧化?氧化? 11.2L
本题解析:化合价升高被氧化,浓硫酸做氧化剂还有酸的作用。在该反应中,若消耗了0.5 mol Cu,则标准状况下生成SO2为0.5mol.
本题难度:一般