1、选择题 把下列四种X溶液分别加入四只盛有10ml?2mol.L-1盐酸的烧杯中,均加入水稀释到50ml,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10℃20ml?3mol?L-1的X溶液
B.20℃30ml?2?mol?L-1的X溶液
C.10℃10ml?2mol?L-1的X溶液
D.20℃10ml?4mol?L-1的X溶液
参考答案:A、10℃20mL3mol/L的X溶液,X的物质的量为0.02L×3mol/L=0.06mol,
B、20℃30mL2mol/L的X溶液,X的物质的量为0.03L×2mol/L=0.06mol,
C、10℃10ml2mol/L的X溶液,X的物质的量为0.01L×2mol/L=0.02mol,
D、20℃10ml4mol/L的X溶液,X的物质的量为0.01L×4mol/L=0.04mol,
显然四种情况下B中温度最高,浓度最大,所以反应速率是最大,
故选B.
本题解析:
本题难度:一般
2、选择题 对于反应:A+B=C下列条件的改变一定能使化学反应速率加快的是
[? ]
A.增加A的物质的量
B.升高体系的温度
C.增加体系的压强
D.减少C的物质的量浓度
参考答案:B
本题解析:
本题难度:一般
3、简答题 某化学研究性小组在用铝与稀硫酸的反应制氢气的实验时发现,如果把在空气中放置一段时间的5.0g铝片放入圆底烧瓶中,然后通过分液漏斗加入500mL?0.5mol/L硫酸溶液,充分反应后,该小组同学根据记录数据得到了产生氢气的速率与反应时间的关系图象(如图所示),请你帮助该小组同学回答下列问题:
(1)曲线OA段不产生氢气的原因是______,有关的离子反应方程式为______;
(2)曲线BC段产生氢气的速率突然加快的主要原因是______;
(3)点C以后产生氢气的速率逐渐减小的主要原因是______;
(4)从理论上分析该小组同学能收集到氢气的体积为(标准状况下)______.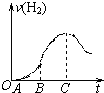
参考答案:(1)铝是活泼性较强的金属,能迅速和空气中的氧气反应生成氧化铝,氧化铝和稀硫酸反应生成氯化铝和水,所以离子方程式为Al2O3+6H+=2Al3++3H2O;
故答案为:硫酸首先与铝片表面的Al2O3反应;?Al2O3+6H+=2Al3++3H2O;
(2)金属和酸的反应是放热反应,所以该反应放热,使溶液的温度升高,升高温度,化学反应速率加快.
故答案为:由于反应放出的热量使溶液温度升高而使反应速率加快了;
(3)随着反应的进行,溶液中的氢离子浓度逐渐降低,所以反应速率逐渐减小;
故答案为:随着反应的进行,硫酸溶液的浓度逐渐下降;
(4)设稀硫酸完全反应需要金属铝xg.
2Al+3H2SO4=Al2(SO4)3+3H2↑
54g? 3mol
xg? 0.5L×0.5mol/L
所以x=4.5<5,故金属铝过量,应以稀硫酸为标准计算生成的氢气体积.
设生成氢气的体积为y.
2Al+3H2SO4=Al2(SO4)3+3H2↑
?3mol? 67.2L
?0.5L×0.5mol/L?y
y=5.6L?
故答案为:5.6?L.
本题解析:
本题难度:一般
4、选择题 硫代硫酸钠溶液与稀硫酸反应的化学方程式为Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O,下列各组实验中最先出现浑浊的是
反应温度/℃ Na2S2O3溶液V/mL c/(mol·L-1) 稀H2SO4V/mL c/(mol·L-1) H2OV/mL
A. 25 5、0.1 10、0.1 5
B. 25 5、0.2 5、0.2 10
C. 35 5、0.1 10、0.1 5
D. 35 5、0.2 5、0.2 10
参考答案:D
本题解析:
本题难度:一般
5、实验题 (12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
①分别取等体积的2 mol/L
硫酸于试管中;
②分别投入大小、 形状相同 形状相同
的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
该同学的实验目的是研究  对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同。
条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
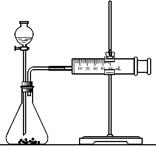
完成该实验应选用的实验药品是
;应该测定的实验数据是 。
参考答案:(共12分)
(1)反应物本身的性质;温度;(每空2分)
(2)Mg(或Fe)、0.5mol/L硫酸和2mol/L硫酸;(6分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
本题解析:略
本题难度:困难