1、选择题 有Fe2+、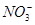 、Fe3+、
、Fe3+、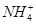 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.氧化剂和还原剂的物质的量之比为1∶8
B.该反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol 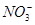 发生氧化反应,转移8 mol e-
发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-=Fe3+
参考答案:C
本题解析:酸性条件下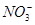 具有强氧化性,Fe3+也具有氧化性,故应是
具有强氧化性,Fe3+也具有氧化性,故应是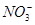 将Fe2+氧化为Fe3+,该反应的离子方程式为8Fe2++
将Fe2+氧化为Fe3+,该反应的离子方程式为8Fe2++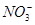 +10H+=8Fe3++
+10H+=8Fe3++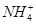 +3H2O,B项正确;氧化剂与还原剂的物质的量之比为1∶8,A项正确;
+3H2O,B项正确;氧化剂与还原剂的物质的量之比为1∶8,A项正确;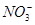 中氮的化合价为+5价,
中氮的化合价为+5价,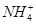 中氮的化合价为-3,故1 mol
中氮的化合价为-3,故1 mol 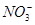 发生了还原反应,C项错误;原电池的负极发生氧化反应,D项正确。
发生了还原反应,C项错误;原电池的负极发生氧化反应,D项正确。
本题难度:一般
2、选择题 已知A2On2-可与B2-反应,B2-被氧化,产物为B单质,A2On2-被还原,产物为A3+;且知100mL c(A2On2-)=0.3mol/L的溶液与150mL c(B2-)="0." 6mol/L的溶液恰好完全反应,则n值为(?)
A.4
B.5
C.6
D.7
参考答案:D
本题解析:根据化合价规则A2On2-中A的化合价为+(n-1),n(A2On2-)=0.1L×0.3mol/L=0.03mol,
n(B2-)=0.15L×0.6mol/L=0.09mol氧化还原反应中氧化剂和还原剂得失电子数目相等,则0.03mol×2×(n-1-3)=0.09mol×(2-0)n=7,选D。
本题难度:一般
3、选择题 一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(铜元素、硫元素的存在形式分别为Cu2+、SO42-)加入足量NaOH稀溶液,产生蓝色沉淀,过滤,洗涤,灼烧沉淀,得到CuO固体12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则VL可能为
A.7.5L
B.9.5L
C.13.6L
D.16.8L
参考答案:B
本题解析:若混合物全是CuS,其物质的量为10=0.15mol,电子转移数,0.15×(6+2)=1.2mol。两者体积相等,设NO xmol,NO2 xmol,3x+x1=1.2,计算的x=0.3。气体体积V=0.6×22.4=13.44L;若混合物全是Cu2S,其物质的量为0.075mol,转移电子数0.075×10=0.75mol, 设NO xmol,NO2 xmol, 3x+x1=0.75,计算得x=0.1875,气体体积0.375×22.4=8.4L,因此选B。
本题难度:一般
4、选择题 硫酸铵在强热时分解的产物是二氧化硫.氮气.氨气.水,则该反应化合价变化和未变化的氮原子数之比为
A.1:4
B.1:2
C.2:1
D.4:1
参考答案:B
本题解析:3(NH4)2SO4=3SO2↑+N2↑+4NH3↑+6H2O,化合价升高的N原子与化合价不变化的N原子个数比为2:4。
点评:此类问题可先写出方程式再分析。
本题难度:一般
5、选择题 锌和很稀的硝酸充分反应,当消耗锌与硝酸的物质的量比为1:2.5时,除生成硝酸锌和水之外还生成另一种物质,该物质可能是
①NO2 ②.N2O ③.NO ④.NH4NO3
A.①②
B.①③
C.②④
D.③④