1、选择题 在反应5NH4NO3 ="=" 2HNO3 + 4N2 + 9H2O中,发生氧化反应与发生还原反应的氮原子个数之比是
A.2:8
B.5:3
C.5:8
D.5:4
参考答案:B
本题解析:略
本题难度:一般
2、简答题 磷单质及其化合物的有广泛应用.
(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
①上述反应中,副产物矿渣可用来______.
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=______
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为______.三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为______
(3)次磷酸钠(NaH2PO2)可用于化学镀镍.
①NaH2PO2中P元素的化合价为______.
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)______Ni2++______?H2PO2-+______→______Ni+______?H2PO3?-+______
(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑
请在答题卡上写出并配平反应式(a).
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:______;原理上的相同点:______;化学镀的优点:______.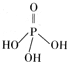
参考答案:(1)①CaSiO3是水泥的主要成分,通常CaSiO3可以用来制水泥,故答案为:生产水泥等建筑材料;
②热化学方程式4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4可以将下列三个反应相加得到:4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1;6Ca3(PO4)2(s)+30C(s)=3P4(g)+18CaO(s)+30CO(g)3△H2;18SiO2(s)+18CaO(s)=18CaSiO3(s)18△H3;根据盖斯定律可得△H=△H1+3△H2+18△H3,故答案为:△H1+3△H2+18△H3;
(2)一个磷酸中的羟基与另一个磷酸的H之间可以脱水.“五钠”即五个钠原子,所以三聚磷酸钠的化学式为:
Na5P3O10,故答案为:Na5P3O10;
(3)①由化合价代数为零可知道NaH2PO2中P元素的化合价为+1,故答案为:+1;
②(a)根据得失电子守恒:镍元素的化合价降低了2价,磷元素的化合价升高的2价,所以根据原子守恒结合电荷守恒可得配平的方程式为:Ni2++H2PO2-+═Ni+H2PO3?-+2H+,故答案为:1,1,1,1,1,2H+;
③从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,故答案为:化学镀无需通电,而电镀需要通电;都利用氧化还原反应;化学镀对镀件的导电性无特殊要求.
本题解析:
本题难度:一般
3、填空题 许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1)重晶石(BaSO4)常做胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10。向BaSO4悬浊液中加入硫酸,当溶液的pH=2时,溶液中c(Ba2+)=?__。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H2O]常做分析剂。
①检验晶体中含有NH4+的方法为?。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2? b.NH4HSO4
c.(NH4) 2SO4?d.(NH4)2SO3,
其中c(NH4+)由大到小的顺序为?__(填选项字母)。
(3)过二硫酸钾(K2S2O8)常做强氧化剂,Na2S2O3常做还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色,该反应的离子方程式为?__。
②用铂做电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为?__,电解过程中阴极附近溶液的pH将?__(填“增大”“减小”或“不变”)。
③产品中K2S2O8的含量可用碘量法测定。操作步骤为称取0.3000 g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以?__为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00 mL。该产品中K2S2O8的质量分数为(杂质不参加反应)?__(列式并计算)。
参考答案:(1)2.2×10-8mol/L
(2)①取少量晶体,加水溶解,再加入足量NaOH浓溶液加热,生成能使湿润的红色石蕊试纸变蓝的气体,则有NH4+
②a>c>d>b
(3)①5S2O82-+2Mn2++8H2O 10SO42-+2MnO4-+16H+
10SO42-+2MnO4-+16H+
②2SO42--2e-=S2O82-(或2HSO4--2e-=S2O82-+2H+) 增大
③淀粉?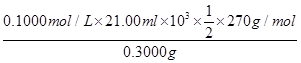
×100%=94.50%
本题解析:(1)Ksp=c(Ba2+)·c(SO42-),所以c(Ba2+)=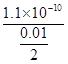 mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--2e-=S2O82-,阴极H+放电,水的电离平衡正向移动,c(OH-)增大;③K2S2O8具有强氧化性可以将I-氧化为I2,所以指示剂选择淀粉,由S2O82-+2I-=2SO42-+I2和I2+2S2O32-=2I-+S4O62-,得关系n(S2O82-)~2n(S2O32-)。
mol/L=2.2×10-8mol/L。(2)②因等物质的量浓度,所以b最小,a相互抑制的双水解、c单水解、d相互促进的双水解,所以c(NH4+):a>c>d>b。(3)①溶液变为紫色说明生成了MnO4-;②阳极失电子化合价升高:2SO42--2e-=S2O82-,阴极H+放电,水的电离平衡正向移动,c(OH-)增大;③K2S2O8具有强氧化性可以将I-氧化为I2,所以指示剂选择淀粉,由S2O82-+2I-=2SO42-+I2和I2+2S2O32-=2I-+S4O62-,得关系n(S2O82-)~2n(S2O32-)。
点拨:本题考查离子反应,考查考生综合分析问题的能力。难度中等。
本题难度:一般
4、填空题 合成氨和制备硝酸是两种重要的化工生产,重庆某化工厂将合成氨与制备硝酸进行连续生产。
(1)在某温度下体积为200 L的氨合成塔中,以分为单位的时间点上测得各物质的浓度(mol·L﹣1)如下表:
?
| 0 min
| l min
| 2 min
| 3 min
| 4 min
|
N2
| 1.500
| 1.400
| 1.200
| c1
| c1
|
H2
| 4.500
| 4.200
| 3.600
| c2
| c2
|
NH3
| 0
| 0.200
| 0.600
| c3
| c3
|
?
根据表中数据得知0 min~2 min内N2的平均反应速率是_______,若3 min末N2的转化率为a,则此时H2的转化率为_______ (用含a的代数式表示)。
(2)今对合成氨反应进行如下研究:在容积均为10 L的a、b、c三个相同密闭容器中分别充入1 mol N2和3 mol H2,三个容器的反应温度分别为T1、T2、T3,在其他条件相同情况下,实验测得反应均进行到5 min时,NH3的体积分数如图所示。则下列说法正确的是_______。
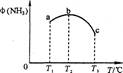
A.a、b、C三容器5 min时的正反应速率大小为:b>a>c
B.达到平衡时,a、b、c中N2转化率为a>b>c
C.5min时,a、b、c三容器中的反应均可能达到平衡状态。
D.将容器b中的平衡状态转变到容器c中的平衡状态,可采取的措施有升温或减压
(3)已知:N2(g)+O2(g)=2NO(g):?△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=﹣905 kJ/mol
2H2(g)+O2(g)=2H2O(g); △H=﹣483.6 kJ/mol
则在该条件下,氨合成塔中所发生反应的热化学方程式为:____________________________;
(4)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,写出该反应的离子方程式:_________________________________________;
(5)取200 mL的硝酸恰好与32 g Cu2S完全反应,已知硝酸被还原成等物质的量的NO和NO2,另外还有CuSO4和Cu(NO3)2生成,则所得工业硝酸的浓度是_______mol·L﹣1。
参考答案:(1)0.15mol·L-1·min (2分);a(2分)
(2)BD(2分)
(3)N2(g)+ 3H2(g) =2NH3(g)?△H= ﹣92.4kJ/mol(3分)
(4)Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH-(3分)
(5)7(3分)
本题解析:(1)根据表中数据可知,在2min内N2的反应速率v(N2)=(1.5-1.2)mol·L﹣1 /2min="0.15" mol·L-1·min;起始时N2 : H2 =1:3,跟方程式的系数比相等,所以N2 、H2 的转化率相等,均为a。
(2)如图,三种温度下反应到5min时,氨气的体积分数不同,根据图像呈现的趋势,氨气的体积分数随温度的升高先升后降,说明在T1 条件下的反应在5min时还没有达到平衡,而在T3条件下反应5,min时已经达到平衡,而且相比T2条件下的反应,升高温度反应逆向移动,正反应为放热:
A.温度越高,反应速率越大,所以a、b、c三容器5min时的正反应反应速率大小为c > b > a,错误。
B.根据上述分析,正反应放热反应,所以温度越高,平衡逆向移动,平衡时候N2转化率越低,所以a>b>c,B正确。
C.根据上述分析,a容器未达平衡,b、c达到平衡,C错误。
D.容器b要变成c的平衡状态,则平衡要逆向移动,则可采取升高温度或者减小压强的措施,D正确。
(3)利用盖斯定律和已知方程式,由①-1/2②+3/2③可得合成氨的热化学方程式为:N2(g)+ 3H2(g) =2NH3(g)?△H= ﹣92.4kJ/mol。
(4) 金属Cu与氨水和双氧水的混合溶液反应生成深蓝色溶液,发生了氧化还原反应,且生成了配合离子,可以类比银氨溶液中的银铵离子[Ag(NH3)2]2+ ,所以生成的配合离子为[Cu(NH3)4]2+ ,反应方程式为:Cu+NH3·H2O+H2O2=[Cu(NH3)4]2+ +4H2O+OH- 。
(5)根据题意得:n(Cu2S)=" 32" g/160g/mol=0.2mol,硝酸与硫化亚铜反应,硝酸为氧化剂和酸,而Cu和S均被氧化,Cu由 +1→+2价, S由-2→+6价,所以失去的电子总数n(e-)=" n(Cu)+8" n(S)=0.4mol+1.6mol=2mol,又n(CuSO4)= n(Cu(NO3)2)=0.2mol,所以作酸的部分硝酸n(HNO3)= 2n(Cu(NO3)2)=0.4mol,作氧化剂的硝酸化合价变化+5→+2价,+5→+4价,且n(NO)= n(NO2),所以的电子总数n(e-)=" 3n(NO)+" n(NO2)="4" n(NO),得失电子守恒,所以有4 n(NO) =2mol,所以可得n(NO)= n(NO2)=0.5mol,所以作氧化剂的硝酸n(HNO3)=" n(NO)+" n(NO2)=1mol,所以总的硝酸n(HNO3)= 0.4mol+1mol=1.4mol,所以硝酸的浓度c(HNO3)=" 1.4mol" /0.2 L=7mol/L。
本题难度:困难
5、选择题 N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2 +N2O。下列关于N2O的说法一定正确的是
A.上述反应中,每消耗2mol NO2,就会生成22.4L N2O
B.N2O有氧化性,且为HNO2的酸酐
C.等质量的N2O和CO2含有相等的电子数
D.N2O会迅速与人体血红蛋白结合,使人中毒
参考答案:C
本题解析:A、未指明标准状况,气体体积不一定是22.4L,错误;B、HNO2的N的化合价是+3价,而N2O中N的化合价是+1价,所以N2O不是HNO2的酸酐,错误;C、N2O和CO2的摩尔质量相同,分子中含有的电子数相同,所以等质量的N2O和CO2含有相等的电子数,正确;D、N2O医疗上曾用作可吸入性麻醉剂,不会与人体血红蛋白结合,产物,答案选C。
本题难度:一般