1、填空题
高锰酸钾是锰的重要化合物和常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。请回答下列问题:
(1)通常高锰酸钾保存在棕色试剂瓶中,下列试剂不需要用棕色试剂瓶保存的是___(填字母代号)。
?a. 浓硝酸 b. 氯水 c. 烧碱
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒机理与下列物质不同的是_______(填字母代号)。
a. 84消毒液(主要成分是NaClO) b. 75%酒精 c. 臭氧 d. 双氧水
(3)写出MnO2催化H2O2溶液制氧气的化学方程式______________。
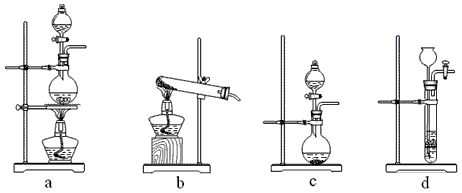
(4)在用软锰矿制备高锰酸钾的生产中需要纯净的CO2气体。
① 若实验室要制备纯净的CO2,从下列给出的试剂中最好选择_______(填字母代号)。
a. 石灰石 b. 浓盐酸 c. 稀硫酸 d. 纯碱
② 与上述所选试剂对应的气体发生装置是_______(填字母代号)。
(5)①通常状况下,酸性高锰酸钾溶液不能与下列物质中的_______反应(填字母代号)。
a. 乙醇 b. Na2SO3溶液 c. 环己烯 d. 苯 e. FeSO4溶液
②将用稀硫酸酸化的高锰酸钾溶液滴入盛有足量草酸溶液的试管中,振荡后,观察到的现象是______________。已知1mol草酸参加反应时转移的电子数是2×6.02×1023,锰元素在生成物中的化合价为+2。请写出此反应的化学方程式_____________________。
2、填空题 (6分)写出298K时,下列反应的热化学方程式
(1)28 g CO还原Fe2O3生成单质铁,放出8.3 kJ热量;?
(2)N2和O2化合生成184 g NO2气体,吸收热量135.4 kJ; ?
3、选择题 Cl2通入70℃的某浓度的氢氧化钠水溶液中,能同时发生两个自身氧化还原反应(未配平):NaOH + Cl2 → NaCl + NaClO + H2O,NaOH + Cl2 → NaCl + NaClO3 + H2O。反应完成后测得溶液中NaClO与NaClO3的数目之比为5:2,则该溶液中NaCl与NaClO的数目之比为
A.3∶1
B.2∶1
C.15∶2
D.1∶1
4、选择题 a mol FeS与b mol FeO投入到V L、c mol/L的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(?)
①(a+b)×63 g?②(a+b)×189 g
③(a+b) mol?④[Vc-(9a+b)/3] mol
A.①④
B.②③
C.①③
D.②④
5、选择题 NaClO2可用作造纸的漂白剂,它由H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2制得,下列说法正确的是
A.H2O2是氧化剂,H2O2中的氧元素被还原
B.每生成1 mol O2转移的电子的物质的量为4 mol
C.ClO2中的氯元素被氧化
D.ClO2是氧化剂,H2O2是还原剂