1、填空题 (1)某学生用KMnO4制备氯气,反应方程式如下:
2KMnO4 + 16HCl = 2KCl + 2MnCl 2+ 5Cl 2↑?+ 8H2O?
当有15.8g KMnO4参加反应时,消耗?molHCl,其中被氧化的HCl有??mol,有?mol电子转移,标准状况下生成Cl 2的体积为?L。
(2)生成的氯气缓慢通入KI-淀粉溶液中,出现蓝色,离子方程式为?,若氯气用量(物质的量)达到KI的3倍时,蓝色完全消失,已知此时生成物中含碘物质只有一种,那么该物质中碘的化合价为?。
参考答案:(1)0.8? 0.5?0.5? 5.6?(2)Cl2 + 2I-= I2 + 2Cl-? +5
本题解析:(1)15.8g高锰酸钾的物质的量是15.8g÷158g/mol=0.1mol,则根据反应的化学方程式可知,参加反应的氯化氢是0.1mol×8=0.8mol。其中被氧化的氯化氢是 。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。
。氯元素的化合价从-1价升高到0价,失去1个电子,则转移电子的物质的量是0.5mol×1=0.5mol。根据方程式可知,生成氯气的体积在标准状况下是0.25mol×22.4L/mol=5.6L。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,反应的离子方程式是Cl2 + 2I-= I2 + 2Cl-。设参加反应的碘化钾是1mol,则氯气是3mol,所以根据电子的得失守恒可知,1mol碘化钾失去3mol×2=6mol,则反应后碘元素的化合价是+5价。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导,有助于培养学生的逻辑推理能力和灵活应变能力。该题的关键是准确判断出有关元素的化合价变化情况,然后根据电子的得失守恒即可得出正确的结论。
本题难度:一般
2、选择题 常温下,下列三个反应都能进行:2W-+X2=W2+2X?-?2Y-+W2=Y2+2W-2X-+Z2=X2+2Z-?由此得到结论正确的是( )
A.反应Y2+2X-=2Y-+X2可以进行
B.Z2氧化性最强,Z-还原性最弱
C.氧化性由强到弱的顺序是:X2,W2,Z2,Y2
D.还原性由强到弱的顺序是:Z-,X-,W-,Y-
参考答案:2W-+X2=W2+2X-,该反应中作X2氧化剂,还原产物是X-,W-作还原剂,氧化产物是W2,所以氧化性X2>W2,还原性W->X-;
2Y-+W2=2W-+Y2,该反应中作W2氧化剂,还原产物是W-,Y-作还原剂,氧化产物是Y2,所以氧化性W2>Y2,还原性Y->W-;
2X-+Z2=2Z-+X2,该反应中作Z2氧化剂,还原产物是Z-,X-作还原剂,氧化产物是X2,所以氧化性Z2>X2,还原性X->Z-;
氧化性强弱顺序为:Z2>X2>W2>Y2,还原性强弱顺序为:Y->W->X->Z-;
A、根据氧化性强弱顺序为:X2>Y2,所以反应Y2+2X-=2Y-+X2无法进行,故A错误;
B、氧化性强弱顺序为:Z2>X2>W2>Y2,所以Z2氧化性最强,还原性强弱顺序为:Y->W->X->Z-,Z-还原性最弱,故B正确;
C、氧化性由强到弱的顺序是::Z2>X2>W2>Y2,故C错误;
D、还原性由强到弱的顺序是:Y->W->X->Z-,故D错误.
故选B.
本题解析:
本题难度:一般
3、选择题 根据下面三个化学方程式判断有关物质的性质比较正确的是
? [? ]
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl2+Cl2 = 2FeCl3
③2FeCl3+2HI= 2FeCl2+2HCl+I2
A.氧化性:I2> H2SO4>Cl2> Fe3+
B.还原性:Cl->Fe2+>SO2>I-
C.氧化性:Cl2> Fe3+ >I2> H2SO4
D.还原性:SO2> Fe2+ > I- >Cl-
参考答案:C
本题解析:
本题难度:一般
4、选择题 氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
aHClO3= bO2↑+ cCl2↑+ dHClO4 + eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是
[? ]
A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为12e-
参考答案:B
本题解析:
本题难度:一般
5、选择题 根据下列实验现象,所得结论正确的是( )
| 实验 | 实验现象 | 结论
A
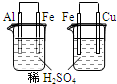
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡
活动性:Al>Cu>Fe
B
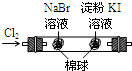
左边棉花变为橙色,右边棉花变为蓝色
氧化性:Cl2>Br2>I2
C
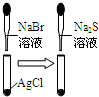
白色固体先变为淡黄色,后变为黑色
溶解性AgCl>AgBr>Ag2S
D
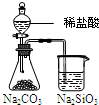
锥形瓶中有气体产生,烧杯中液体变浑浊
非金属性:Cl>C>Si
|
A.A
B.B
C.C
D.D
参考答案:A.左烧杯中铁表面有气泡,说明活动性Al>Fe,右边烧杯中铜表面有气泡,说明活动性Fe>Cu,则活动性为Al>Fe>Cu,故A错误;
B.因生成的Br2中含有Cl2,则不能证明氧化性Br2>I2,故B错误;
C.白色固体先变为淡黄色,说明溶解性AgCl>AgBr,后变为黑色,说明溶解性AgBr>Ag2S,故C正确;
D.比较非金属性应为最高价氧化物的水化物的酸性,不能用盐酸,并且盐酸易挥发,生成的二氧化碳中混有HCl,不能证明非金属性C>Si,故D错误.
故选C.
本题解析:
本题难度:一般