1、选择题 A、B、C、D四种物质皆易溶于水,且在水溶液中存在如下化学平衡,加水稀释后,平衡向正反应方向移动的是……( )
A、A+B C+D B、A+H2O
C+D B、A+H2O C+D C、A+B
C+D C、A+B C+H2O D、A+2B+H2O
C+H2O D、A+2B+H2O C
C
参考答案:B
本题解析:首先注意到所加水属于纯液体,固体和纯液体的量的增减对化学平衡移动是没有影响的,但加水可以改变其它物质的浓度,从而影响化学平衡。A选项,加水稀释A、B、C、D均为相同倍数,故平衡不移动。B选项,A与C、D各稀释相同倍数,C、D为生成物两种浓度的减小,大于A物质(反应物)浓度的减小,利用勒夏特列原理,平衡右移。同样道理,C、D两个选项,平衡均左移。
本题难度:一般
2、简答题 某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
| 实验步骤 | 向3-4mL?1mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全
实验现象
产生白色沉淀
离子方程式
______
小组讨论交流
向上述反应后的清液中滴入适量1mol/L的Na2CO3?溶液会出现什么现象
假设出现的实验现象,说明理由
假设:Ⅰ无现象 ?理由:反应没有限度,Ca2+沉淀完全
假设:Ⅱ______,理由:______
证明你的假设
现象:产生大量的白色沉淀
离子方程式
______
解释
______
参考答案:(1)CaSO4在水中微溶,CaCl2溶液中滴入Na2SO4溶液生成沉淀CaSO4,反应的离子方程式为Ca2++SO42-=CaSO4↓,
故答案为:Ca2++SO42-=CaSO4↓;
(2)向上述反应后的清液中滴入适量1mol/L的Na2CO3溶液,如反应没有限度,Ca2+沉淀完全,则无现象,如反应存在限度,溶液中尚有较多Ca2+,则应生成白色沉淀CaCO3,
故答案为:产生白色沉淀;反应存在限度,溶液中尚有较多Ca2+;
(3)CaCO3在水中难溶,反应后的清液中滴入适量1mol/L的Na2CO3溶液生成白色沉淀CaCO3,
反应的离子方程式为Ca2++CO32-=CaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓;
(4)CaCO3在水中难溶,CaSO4在水中微溶,说明CaCO3的溶解度较CaSO4小,从可逆反应的角度思考,Ca2++SO42-

CaSO4↓反应是可逆反应,存在溶解平衡,加入CO32-产生了大量的白色沉淀,属于沉淀的转化问题,
故答案为:加入CO32-产生了大量的白色沉淀,说明Ca2++SO42-

CaSO4↓反应是可逆反应,存在反应限度,
所以Ca2+不能反应完,才出现这种现象.
本题解析:
本题难度:一般
3、选择题 可逆反应: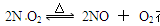 在体积固定的密闭容器中,不能用于判断该反应处于平衡状态的是 在体积固定的密闭容器中,不能用于判断该反应处于平衡状态的是
A.单位时间内,生成n mol O2的同时生成2n mol NO2
B.单位时间内,生成n mol O2的同时消耗2n mol NO
C.某时刻NO2、NO、O2的物质的量浓度之比为2∶2∶1
D.混合气体的颜色不再改变
参考答案:C
本题解析:A表示υ正(O2):υ逆(NO2)=1:2,故正确;
B表示υ正(O2):υ逆(NO)=1:2,故正确;
达平衡态时,各组分浓度保持一定值不变,但与方程式中的系数无关,故C错误;
“混合气体的颜色不再改变”表示NO2的浓度不再变化,则其余各组分浓度也不再变化,故D正确;
本题难度:简单
4、选择题 下列推断正确的是
A.由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ
B.由C(石墨)=C(金刚石)△H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定
C.由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ
D.由△G=△H-T△S可知,所有的放热反应都能自发进行
|
参考答案:B
本题解析:A.醋酸是弱酸,溶于水存在电离平衡,电离吸热,因此由H+(aq)+OH-(aq)=H2O(1) △H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量小于57.3 kJ,A错误;B.由C(石墨)=C(金刚石) △H=+1.9 kJ·mol-1,可知石墨的能量低于金刚石,因此石墨比金刚石更稳定,B正确;C.合成氨的反应是可逆反应,则由N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量小于92.4 kJ,C错误;D.由△G=△H-T△S可知,所有的放热反应不一定都能自发进行,还需要考虑△S的大小,D错误,答案选B。
考点:考查反应热的有关判断与应用
本题难度:一般
5、选择题 下列说法正确的是
[? ]
A.凡是放热反应都是自发的,吸热反应都是非自发的
B.自发反应一定是熵增加,非自发反应一定是熵不变或减少
C.自发反应在恰当的条件下才能实现
D.自发反应在任何条件下才能实现
参考答案:C
本题解析:
本题难度:一般