1、实验题 (13分) CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
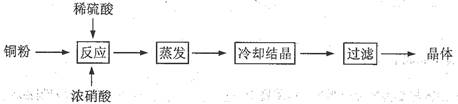
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:?、?。
(2)有同学认为此种方法会生成有毒的氮的氧化物, 且所得晶体可能混有硝酸铜。建议将浓硝酸换成其它氧化剂,你觉得呢?若有同感,请选择合适的试剂完成下列反应(若有反应条件的应注明):
__Cu + __H2SO4 + __________→ __CuSO4 +_______________
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+ Na2SO4
相对分子质量:CuSO4:160? H2O:18
称取0.1000 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.1000 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用0.1000 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则该试样中含CuSO4·5H2O的质量分数为?。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用?。
(5)如果采用重量法测定CuSO4·5H2O的含量,完成下列步骤:
①称取样品a g②加水溶解③加氯化钡溶液,沉淀④过滤、?、干燥⑤称量所得固体b g。
在过滤前,需要检验是否沉淀完全,其操作是?
则a g该试样中含CuSO4·5H2O的质量为??g (用含b的代数式表示)。
[相对原子质量:H-1? O-16? S-32? Ba-137]
参考答案:(1)溶液呈蓝色,有红棕色气体生成2分
 ?(2)Cu + H2SO4 + H2O2= CuSO4 +2H2O或
?(2)Cu + H2SO4 + H2O2= CuSO4 +2H2O或
2Cu + 2H2SO4 + O2==2CuSO4 ++2H2O? 2分
(3)98%? 2分
(4)标准盐酸溶液润洗2~3次? 2分?
(5)洗涤1分?在上层清液中继续滴加加氯化钡溶液,观察有无沉淀产生2分
250b/233 g? 2分
本题解析:略
本题难度:一般
2、选择题 在氯化铁、氯化铜和盐酸混和溶液中加入铁粉,待反应结束,铁粉有剩余,则反应后溶液中存在较多的阳离子是
A.H+
B.Fe2+
C.Fe3+
D.Cu2+
参考答案:B
本题解析:注意审清题意, “反应结束后,Fe有剩余”,再逐一分析各项。A项溶液中如果剩余大量H+,则铁粉不会剩余,不正确;B项Fe2+与Fe不反应,会有Fe剩余;C项Fe3+会与Fe 发生反应:2Fe3++Fe=3Fe2+,Fe不会剩余;D项Cu2+会与Fe发生反应:Cu2++Fe=Fe2++Cu,Fe不会剩余。
点评:熟记铁及其化合物的常见化学反应
本题难度:一般
3、填空题 (12分)纳米级四氧化三铁是应用最为广泛的软磁性材料之一,常用作记录材料,磁流体材料,催化剂,电子材料等。其在生物技术领域和医学领域也有很好的应用前景。共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图示:
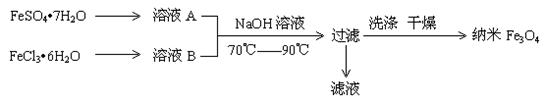
请回答下列问题:(1)实验室保存溶液A时,需加入?。
(2)为了得到较纯的纳米Fe3O4,FeSO4·7H2 O 和 FeCl3·6H2O的物质的量之比最好应为?,在此条件下,检验铁元素是否沉淀完全的实验操作是?。
O 和 FeCl3·6H2O的物质的量之比最好应为?,在此条件下,检验铁元素是否沉淀完全的实验操作是?。
(3)写出制备纳米Fe3O4的离子反应方程式?。
(4)共沉淀法的主要不足是:①得到的Fe3O4纳米粒子间存在团聚现象
②?。
(5)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁硫体的说法中不正确的是:?。
A.纳米Fe3O4磁硫体分散系属于溶液。
B.纳米Fe3O4磁硫体可 以通过渗析法得到提纯。
以通过渗析法得到提纯。
C.当一束可见光通过该磁硫体时会出现光亮的通路。
D.纳米Fe3O4磁硫体比较稳定。
参考答案:

本题解析:略
本题难度:一般
4、填空题 铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为:3FeS2+8O2 6SO2+Fe3O4,3 mol FeS2参加反应转移?mol电子。
6SO2+Fe3O4,3 mol FeS2参加反应转移?mol电子。
(2)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式?。
从腐蚀废液回收得到金属铜还需要的试剂为__________?_______________。
(3)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是?。
(4)下表中,对陈述I、II的正确性及其有无因果关系的判断都正确的是__?__。(填字母)
选项
| 陈述I
| 陈述II
| 判断
|
A
| 铁是地壳中含量最高的金属元素
| 铁是人类最早使用的金属材料
| I对;II对;有
|
B
| 常温下铁与稀硫酸反应生成氢气
| 高温下氢气能还原氧化铁生成铁
| I对;II对;无
|
C
| 铁属于过渡金属元素
| 铁和铁的某些化合物可以用作催化剂
| I错;II对;无
|
D
| 铁在空气中表面生成致密氧化膜
| 可用铁罐储存运输浓硫酸、浓硝酸
| I对;II对;有
参考答案:(14分)
(1)32(3分)
(2)2Fe3+ + Cu = 2Fe2+ + Cu2+(3分)?铁粉、稀硫酸(2分)
(3)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体(3分)
(4)B (3分)
本题解析:略
本题难度:一般
5、实验题 某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下。
提出猜想
问题1:在周期表中,铜与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也有两性吗?
问题2:铁和铜都有变价,一般情况下,正二价铁的稳定性小于正三价的铁,正一价铜的稳定性也小于正二价的铜吗?
问题3:氧化铜有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原吗?
实验探究
Ⅰ. 解决问题1
(1)需用到的药品除1 mol·L-1CuSO4溶液、稀硫酸外还需?(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol·L-1CuSO4溶液250 mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有?(填仪器名称)。
(3)为达到实验目的,你认为应进行哪些相关实验?
实验内容和步骤:①?;②?。
Ⅱ. 解决问题2
取一定量制得的氢氧化铜固体,于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。根据以上实验现象回答问题。
(1)写出氧化亚铜与稀硫酸(或盐酸)反应的离子方程式:?,
(2)从实验Ⅱ可得出的结论是?。
Ⅲ. 解决问题3
设计如下装置(夹持装置未画出):

当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的气体Y;将X通入灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36 g,并收集到0.28 g单质气体Y。
(1)X气体的摩尔质量是?。
(2)C中发生反应的化学方程式为?。
参考答案:Ⅰ(1)NaOH溶液(1分 )
(2)250mL容量瓶(1分)
(3)①用CuSO4溶液与NaOH溶液反应制Cu(OH)2(1分)?②Cu(OH)2分别与稀硫酸、稀NaOH溶液反应(1分)
Ⅱ(1)Cu2O+2H+=Cu2++Cu↓+H2O(2分)
(2)高温下+1价Cu比+2价Cu稳定,溶液中+2价Cu比+1价Cu稳定(2分)
Ⅲ(1)32 g·mol-1(2分)
(2)2CuO+N2H4? =? 2Cu+N2+2H2O(2分)
本题解析:Ⅰ(1)探究氢氧化铜是否能和硫酸和氢氧化钠反应的实验需要的药品是:制取氢氧化铜的硫酸铜和氢氧化钠,验证试验用到硫酸和氢氧化钠,所以需要硫酸铜和氢氧化钠以及硫酸溶液。(2)配制一定物质的量浓度的溶液所需仪器:烧杯、天平、玻璃棒、量筒、胶头滴管、一定体积的容量瓶,容量瓶的规格根据所配置的溶液来确定,故答案为:250mL容量瓶;(3)氢氧化铜是否能和硫酸和氢氧化钠反应的实验中,首先是氢氧化铜的配制,然后是让氢氧化铜和硫酸以及氢氧化钠反应,所以实验步骤第一步是:用CuSO4溶液和NaOH溶液制Cu(OH)2;第二步是:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应,故答案为:将Cu(OH)2分别与稀H2SO4和NaOH溶液反应;Ⅱ、(1)氧化亚铜与稀硫酸(或盐酸)反应生成金属单质铜和二价铜离子的盐溶液,反应实质是:Cu2O+2H+=Cu+Cu2++H2O,故答案为:Cu2O+2H+=Cu+Cu2++H2O;(2)根据溶液中的离子反应Cu2O+2H+=Cu+Cu2++H2O 可以知道在溶液中Cu2+的稳定性强于Cu+,再根据Cu+的外围电子排布式为3d10,外围电子排布中全充满状态和半充满状态均比较稳定Cu+的外围电子排布为3d10,全充满状态,,故比较稳定;Ⅲ、(1)金属铜不能和稀硫酸反应,氧化亚铜能和稀硫酸反应,生成硫酸铜蓝色溶液,故答案为:将红色物质置于稀硫酸中,溶液不变蓝,则证明为铜;(2)消耗0.01mol X,测得B装置增重0.36g,即生成0.02mol的水,并收集到单质气体Y 0.28g即氮气0.01mol,根据原子守恒可以确定气态氢化物X中含有4个氢原子和2个氮原子,X的化学式为N2H4,摩尔质量为32 g·mol-1。和氧化铜反应的化学方程式为:2CuO+N2H4=2Cu+N2+2H2O,故答案为:2CuO+N2H4=2Cu+N2+2H2O。
本题难度:一般
|