1、实验题 (16分)铜与浓硫酸反应,实验装置如图所示。
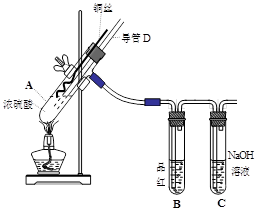
(1) 装置A中发生反应的化学方程式为:?,反应过程中试管B中的现象是?,试管C的作用是?。
(2) 导管D的下端(虚线段)应位于?(液面上、液面下),导管D的作用有:①实验结束后排除装置中的SO2;②?。
实验中发现试管内除了产生白色固体外,在铜丝表面还有黑色固体甲生成,甲中可能含有CuO、Cu2O、CuS、Cu2S。为探究甲的成分,进行了以下的实验。
查阅资料可知:Cu2O + 2HCl =CuCl2+ Cu + H2O, 2Cu2O + O2煅烧 4CuO,2CuS+3O2煅烧2CuO+2SO2,Cu2S+2O2煅烧2CuO+SO2。CuS、 Cu2S和稀HCl不反应。
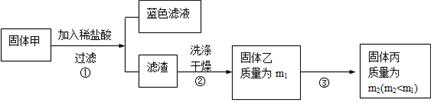 (3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(3) 固体乙在空气中煅烧时,使用的实验仪器除了玻璃棒、三脚架、酒精灯外,还必须有:?。
(4) 煅烧过程中,除上述反应外,还可能发生反应的方程式为?。
(5)结论:甲中有CuO,还肯定含有的物质是?。
参考答案:33.(16分)(1)Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O (2分)、品红溶液褪色(2分)、吸收多余的SO2,防止污染空气(2分)
(2)液面下;防倒吸 (4分)
(3)泥三角、坩埚(坩埚钳)(2分,坩埚钳不写不扣分)
(4)2Cu+O2△2CuO (2分)
(5)CuS(2分)
本题解析: (1) 该实验研究的是铜与浓硫酸的反应,因此在A装置中发生的反应方程式为Cu +2H2SO4(浓) △CuSO4+SO2↑+2H2O。反应中有SO2生成,因此B中的品红溶液被漂白褪色,C试管起到吸收过量SO2的目的,防止SO2污染空气。
(2) 由于A装置是制备SO2的发生装置,所以导管D的下端必须插入溶液中,才能防止产生的SO2不会从导管D中逸出来;而导管D的作用是在实验结束后用于排除A装置的SO2,同时能够平衡A和B中气压,防止B中液体倒吸。具体操作就是把D下端从溶液中提起。
(3) 煅烧的实验用具必须使用耐高温的坩埚,而与坩埚配套使用的还有泥三角、坩埚钳等。
(4)根据题中的判断,该固体甲可能是CuO、Cu2O、CuS、Cu2S,因此用稀盐酸溶解,根据已知的反应,反应得到的固体乙可能是Cu、CuS、Cu2S,对固体乙进行煅烧,因此除了已知的几个煅烧反应外,还可能发生的反应为单质铜的煅烧2Cu+O2△2CuO。
(5) 根据(4)的分析,利用反应的方程式对各种成分煅烧结果进行推断分析,若Cu煅烧,煅烧生成CuO使质量增重;若CuS煅烧,煅烧产生CuO使质量减小;若Cu2S煅烧,煅烧生成CuO是质量不变。因此要满足流程中煅烧前后质量减小,则固体中必须还含有能使煅烧前后质量减小的CuS。
本题难度:一般
2、实验题 铁及其化合物在生产和生活中有着广泛的应用。某实验小组设计了如下实验探究
某些含铁化合物的制备、组成、性质等。请按要求回答下列问题:
(1)铁的氯化物的制备与组成:在实验室中,FeCl2可用________和盐酸反应制备,FeCl3可用铁粉和
________反应制备。现有一含有FeCl2和FeCl3的混合物样品,测得n(Fe)∶n(Cl)=1∶2.2,则该样
品中FeCl2和FeC13物质的量之比为__________。
(2)水处理剂和高容量电池材料――高铁酸钾(K2FeO4)的制备与应用:
FeC13与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
________________________________________________________________________;
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,其正极电极反应式为
________________________________________________________________________。
(3)光敏材料三草酸合铁酸钾晶体(K3[Fe(C2O4)3]·xH2O)中铁元素含量的测定:
步骤一:称量10.00 g三草酸合铁酸钾晶体,配制成250 mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳。同时MnO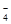 被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
被还原成Mn2+。向反应后的溶液中加入适量锌粉,至黄色刚好消失,所得溶液收集到锥形瓶中,此时溶液仍呈酸性。
步骤三:用0.0200 mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02 mL,滴定中MnO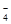 还原成Mn2+。
还原成Mn2+。
重复步骤二、三操作,步骤三消耗0.0200 mol/L KMnO4溶液19.98 mL。
①步骤一中除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有____________________;步骤三滴定过程中盛装KMn4溶液的仪器名称为___________;滴入最后一滴溶液时,锥形瓶中溶液变为_________色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②步骤二加入锌粉的目的是_______________________________;
写出锌参与反应的离子方程式:____________________________________________。
③实验测得该晶体中铁元素的质量分数为____________。在步骤二中,若加入的KMnO4溶液的量不足,则测得的铁元素含量____________。(填“偏低”“偏高”或“无影响”)
参考答案:(18分)(1)铁粉?氯气 (2分);4∶1(2分)
(2)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O(2分)
FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-(2分)
(3)①250ml容量瓶和胶头滴管(2分);酸式滴定管?红(2分)
②将Fe3+还原成Fe2+(1分);Zn+2Fe3+=Zn2++2Fe2+(2分)?③11.2%(2分)?偏高(1分)
本题解析:(1)铁是变价金属,与强氧化剂反应生成+3价铁,与弱氧化剂反应生成+2价铁,所以在实验室中,FeCl2可用铁和盐酸反应制备,FeCl3可用铁粉和氯气反应制备。设样品中FeCl2和FeC13物质的量分别是x 和y,则根据混合物n(Fe)∶n(Cl)=1∶2.2可知,(x+y):(2x+3y)=1∶2.2,解得x∶y=4∶1。
(2)FeC13与KClO在强碱性条件下反应可制取K2FeO4,在反应中氯元素的化合价从+1价降低到—1价,得到2个电子。铁元素的化合价从+3价升高到+6价,失去3个电子,即还原剂与氧化剂的物质的量之比是2:3,因此该反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;原电池种正极得到电子,所以在K2FeO4-Zn碱性电池中,锌是负极,K2FeO4是正极,所以正极电极反应式为FeO42-+3e-+4H2O=Fe(OH)3↓+5OH-。
(3)①配制一定物质的量浓度溶液时,除量筒、玻璃棒、烧杯外,还需要的玻璃仪器有250ml容量瓶和定容的胶头滴管。由于高锰酸钾溶液极易强氧化性,且显酸性,所以步骤三滴定过程中盛装KMn4溶液的仪器名称为酸式滴定管;酸性高锰酸钾溶液显红色,所以滴入最后一滴溶液时,锥形瓶中溶液变为红色,静置半分钟溶液颜色不再变化,确认为滴定终点。
②由于酸性高锰酸钾溶液也能把亚铁离子氧化生成铁离子,所以加入锌粉的作用是将Fe3+还原成Fe2+,反应的离子方程式为Zn+2Fe3+=Zn2++2Fe2+。
③两次实验中消耗0.0200 mol/L KMnO4溶液的平均值=(20.02 mL+ 19.98 mL)÷2=20.00ml,所以消耗高锰酸钾的物质的量是0.0200L×0.0200 mol/L=0.0004mol。根据电子得失守恒可知,溶液中亚铁离子的物质的量=0.0004mol×5=0.0020mol,所以该晶体中铁元素的质量分数为 ×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
×100%=11.2%。在步骤二中,若加入的KMnO4溶液的量不足,则可能导致草酸根剩余,从而导致第三步中消耗高锰酸钾溶液的体积增加,从而导致铁元素的含量偏高。
本题难度:困难
3、计算题 将适量的铁粉加入FeCl3溶液中,充分反应后,溶液中的Fe3+和Fe2+浓度相等,则加入的铁粉和原来的FeCl3物质的量之比为多少
参考答案:设参加反应的铁的物质的量是x,原FeCl3物质的量是y,则
Fe+2Fe3+=3Fe2+
1? 2? 3
x? 2x? 3x
所以有3x=y-2x
解得x︰y=1︰5
本题解析:考查根据方程式进行的有关计算。
本题难度:一般
4、选择题 C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
A.反应后的固体混合物中还含有碳
B.反应后的固体混合物总质量为13.6 g
C.反应后的固体混合物中氧化物的物质的量为0.05 mol
D.反应后的固体混合物中单质Cu的质量为12.8 g
参考答案:BC
本题解析:n(C)=0.1mol,n(CuO)=0.2mol.n(CaCO3)=n(CO2)=" 5.00" g÷100g/mol= 0.05mol,n(CO)="1.12L÷" 22.4L/mol ="0.05mol," n(CO2)+ n(CO)=n(C)=0.1mol所以固体中无碳单质存在。气体中的氧元素的物质的量为n(O)= 2n(CO2)+ n(CO)=0.15mol< n(CuO)=0.2mol,所以固体中还含有0.05mol的Cu2O其质量为0.05mol×144g/mol=7.2g,,含有Cu的质量为(0.2mol-0.05mol×2)×64g/mol=6.4g.所以固体的总质量为7.2g+6.4g="13.6" g.故正确选项为B C。
本题难度:一般
5、选择题 质量为ag的铜丝,在空气中灼烧变黑,趁热放入下列物质中,铜丝变为红色,而且质量仍为ag的是?
A.盐酸
B.2-丙醇
C.一氧化碳
D.硝酸
参考答案:BC
本题解析:铜在空气中加热,生成氧化铜,氧化铜能和酸反应,如果是硝酸,铜也被溶解,所以铜的质量减少。2-丙醇和CO能把氧化铜还原生成铜,因此质量不变,答案选BC。
点评:该题是高考中的常见题型,属于中等难度的试题。试题设计新颖,难易适中。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和方法的指导与训练。该题的关键是明确铜参与有关化学反应的原理,然后灵活运用即可。
本题难度:简单