微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 完全溶解28.4 g碳酸铜和氢氧化铜的混合物需要消耗1 mol·L-1的盐酸500 mL。若灼烧相同质量的上述混合物,能得到氧化铜的质量为
A.40 g
B.30 g
C.20 g
D.16 g
参考答案:C
本题解析:依题意,按盐酸与氧化铜关系式速算:
CuO?—? 2HCl(由CuCl2产物推之)
80 g?????? 2 mol
x????????? 1 mol·L-1×0.5 L
解之:x="20" g
本题难度:简单
2、实验题 (16分)某课外活动小组欲利用下列装置(部分固定装置略)完成下列实验;
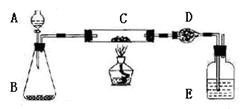
(一)实验目的:测定铜粉(含炭)样品中铜的质量分数
(二)实验用品:仪器:天平、分液漏斗、锥形瓶、硬玻璃管、干燥管、酒精灯、洗气瓶药品:红褐色铜粉(含炭)样品、过氧化氢溶液、二氧化锰、碱石灰。浓硫酸等
(三)实验内容:
在答题卡上按完成下表空白处内容
步骤
| 实验过程
| 实验现象
| 有关化学方程式
|
1
| ?
| 
| .com
|
2
| 在C中加入样品W克,D中装入碱石
灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。
| ?
| ?
|
3
| 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热:
| ?
| ?
|
4
| 冷却后,称量D的质量为m2克。
| 
| 
??????(四)计算:样品中铜的质量分数=______________(用含W、m1.m2的代数式表示)
(五)问题和讨论:
该小组重复测定了三次,得到铜的质量分数的数据存在较大的偏差,你认为原因可能是??????????????。
A.装置内原有空气中的二氧化碳气体也被碱石灰吸收
B.装置B中的产生的气体中的水蒸气通过C被D中碱石灰吸收
C.反应完成后,装置中的二氧化碳没有全部被碱石灰吸收
参考答案:(三)
步骤
实验过程
实验现象
有
本题解析:略
本题难度:简单
3、选择题 下列变化不能通过一步反应直接完成的是( )
A.Al→AlO2-
B.Na2CO3→NaOH
C.Al2O3→Al(OH)3
D.Fe(OH)2→Fe(OH)3
参考答案:C
本题解析:
本题难度:简单
4、实验题 人教版《必修1》关于Fe3+和Fe2+的转化的实验探究,某校教师为了检验学生完成每个实验过程时相应的问题解决思路,特设计一份化学探究学习“过程-思路”问卷。
(1)请在下表中右栏填写设计每一步操作过程的思路
过程
| 思路
| 1.提出假设:Fe2+具有还原性,可以被氧化成Fe3+;Fe3+具有氧化性,可以被还原成Fe2+
| ①根据氧化还原反应原理,一般?????物质有还原性,????????物质有氧化性
| 2.设计实验1:取少量FeCl2溶液,滴加几滴H2O2溶液,再向溶液中滴加几滴KSCN溶液,观察溶液是否变血红色
| ②用离子方程式表示选择H2O2的原因?????
③用离子方程式表示溶液变血红色的原因???
| 3.设计实验2:取少量FeCl3固体于一试管,用已煮沸的蒸馏水溶解,滴加几滴KSCN溶液后迅速加入少量铁粉,盖上试管塞,观察溶液的血红色是否褪去
| ④选择铁粉的原因是??????????(用化学方程式表示)
⑤为什么要用煮沸的水?????????????????
| 4.实施实验
| ……
| ……
| ……
?
(2)教材中实验方案如下:取2mLFeCl3溶液,加入少量铁粉,充分反应后,滴入几滴KSCN溶液,观察并记录实验现象。把上层清液倒入另一试管中,再滴入几滴氯水,又发生了什么变化?学生通过实践证明,实验效果很差:没有预期的红色出现,而是很淡的浅红色,试分析实验中出现异常的可能原因并加以改进使实验现象更明显。
⑥可能的原因:????????????????????????????????????????????????????????????
⑦改进措施:??????????????????????????????????????????????????????????????
参考答案:
(1)①低价(态)??高价(态) (1+1=2分)
本题解析:实验探究题(1)①根据所给出的离子,从化合价的角度分析氧化还原性,低价物质具有还原性,高价物质具有氧化性;②加入双氧水具有氧化性把Fe2+氧化成Fe3+④铁粉用来还原Fe3+转化为Fe2+;⑤除去溶液中溶解的气体一般采用加热的方法,因为温度高气体溶解度降低;(2)溶液颜色没有出现红色,原因可能是Fe3+ 和SCN-缺少一种,溶液中氯水能氧化出Fe3+ ?,所以结果只有一种可能就是SCN-被氧化。为了避免SCN-氧化,应先加入氯水后,在加入KSCN溶液,具体操作应为取适量FeCl3溶液,加入足量铁粉,然后将
本题难度:一般
5、填空题 (8分)向FeCl3溶液中加入ag铜粉,搅拌使之全部溶解,再向其中加入 bg铁粉,充分反应后过滤得滤渣 cg,若已知 a>b>c,则 c克滤渣是______。溶液中存在的阳离子是____??? __。
参考答案:Cu Fe2+、Cu2+
本题解析:略
本题难度:一般
|
|