微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
已知:Ksp[Fe(OH)3]=4.0×10-38
回答下列问题:
(1)FeCl3蚀刻铜箔反应的离子方程式为______________________________;
(2)过程Ⅰ加入铁屑的主要作用是________,分离得到固体的主要成分是______________,从固体中分离出铜需采用的方法是________________;
(3)过程Ⅱ中发生反应的化学方程式为______________;
(4)过程Ⅱ中调节溶液的pH为5,金属离子浓度为________。(列式计算)
2、填空题 (13分)(Ⅰ)W、X、Y、Z是周期表前36号元素中的四种常见元 素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的
素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的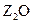 和黑色的ZO两种氧化物。
和黑色的ZO两种氧化物。
(1)W位于元素周期表第_________周期第_________族。
W的气态氢化物稳定性比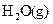 __________(填“强”或“弱”)。
__________(填“强”或“弱”)。
(2)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
_________________________________________________________________________。
(3)???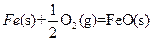 ?????????
?????????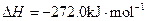
 ??????
??????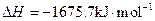
X的单质和FeO反应的热化学方程式是_________________________________________。
(Ⅱ)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为____________???????????__
(2)Y元素原子的价层电子的轨道表示式为____________???????????_
(3)X与Z可形成化合物XZ3,该化合物的空间构型为_____??___
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是________________________________________。
3、填空题 (18分)工业上以黄铜矿(主要成分CuFeS2)为原料制备CuSO2·5H2O的主要流程如下:

(1)下列装置可用于吸收气体X的是___________(填代号)。
(2)某研究性学习小组用泡铜与CO反应来制取粗铜。
①装置B中的药品为_____________。??
②实验时,依次进行如下操作:组装仪器、__________________、加装药品、通入气体、_____________________、点燃酒精灯。
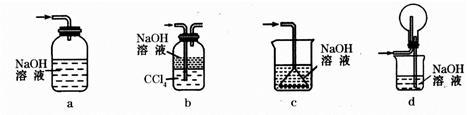
(3)熔渣Y的成分为Fe2O3和FeO,选用提供的试剂,设计实验验证熔渣中含有FeO。写出有关实验操作、现象与结论。?
提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、氯水。
_______________________________________________________________________。
(4)向粗铜中加入硫酸和硝酸的混酸溶液制取硫酸铜时(杂质不参加反应),混酸中H2SO4与HNO3的最佳物质的量之比为___________________。
(5)用滴定法测定所得产品中CuSO4·5H2O的含量,称取a g样品配成100 mL溶液,取出20.00 mL,用c mol·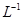 滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下:
滴定剂EDTA(H2Y2-)标准溶液滴定至终点(滴定剂不与杂质反应),消耗滴定剂b mL。滴定反应如下: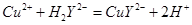 。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
。则CuSO4·5H2O质量分数为__________。滴定管用蒸馏水洗涤后,直接注入标准溶液,则会导致测定结果偏_______。
4、填空题 实验题(14分):Ⅰ、HCOOH是一种无色、易挥发的液体,某学习小组参照: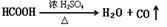 原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。
原理,用下列仪器(加热及固定装置省略)制备干燥、纯净的CO,并用CO还原CuO粉末。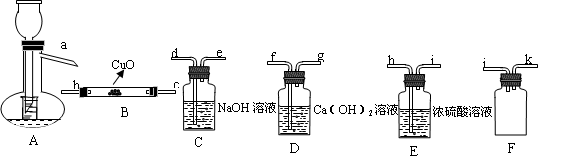
(1)若所制气体流向从左向右时,上述仪器连接为: A→(?? ) →(??? )→(??? )→(?? ) →(?? )
(2)A装置中小试管的作用(至少答两条):
①???????????????????????????????。②???????????????????????????????。
(3)证明HCOOH受热产物中有CO的现象为:????????????????????????????。
(4)本实验有3处用到酒精灯,除A、B处外,还缺一个酒精灯,应放在???????处.
Ⅱ、学习小组查阅资料知:
Cu的颜色为红色或紫红色,而Cu2O的颜色也为红色或砖红色。②4CuO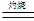 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此对CO充分还原CuO后所得红色固体是否含有Cu2O进行了认真的研究,提出下列设计方案:
方案①:取该红色固体溶于足量稀硝酸中,观察溶液颜色的变化。
方案②:取该红色固体溶于足量稀硫酸中,观察溶液颜色的变化。
(5)写出Cu2O与稀硝酸反应的化学方程式:?????????????????????????????????。
(6)请你评价方案②的合理性,并简述理由:方案②:????????????,理由:????????????????????????。
5、选择题 FeSO4和Fe2(SO4)3的混合物中含硫的质量分数为a%,则含铁的质量分数为(?????? ).
A.2a%
B.3a%
C.1-2a%
D.1-3a%