微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 1,2,3,4—四氢化萘的结构简式如下图, 分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+ 4Br2→ C10H8Br4+ 4HBr生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:
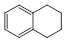

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④ 分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
(1) 如图所示的装置, 适合步骤①和②的操作的是????????????????????????。
(2) 步骤②中如何判断“反应完全”_________________________________________。
(3) 步骤③中补充少量四氢化萘的目的是??????????????????????????????????。??
(4) 步骤③中过滤后得到的固体物质是____________??????????????_________。
(5) 已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中水和四氢化萘的质量比约是1:____________(保留小数点后1位)。
2、选择题 现欲用浓度为5 mol/L 的NaOH溶液配制 1 mol/L 的NaOH溶液,应取 5 mol/L的NaOH溶液与蒸馏水的体积比约为(???)
A.1: 4
B.1: 5
C.2: 1
D.2:3
3、选择题 下列实验能达实验目的是
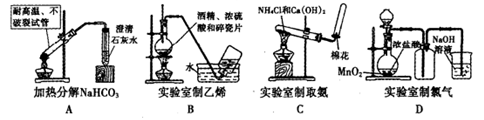
4、选择题 下列气体的制备可采用右图装置的是
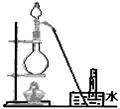
A?铜与浓硝酸反应制NO2
B?铜与稀硝酸反应制NO
C? Zn与1摩/升硫酸反应制H2
D?氯化钠与浓硫酸反应制HCl
5、实验题 (12分)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1?将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。
步骤2?向处理过的铁屑中加入过量的3mol·L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3?向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有__________(填仪器编号)
①铁架台? ②燃烧匙? ③锥形瓶? ④广口瓶? ⑤研钵? ⑥玻璃棒? ⑦酒精灯
(2)在步骤2中趁热过滤,其原因是________________________________;
(3)在步骤3制的的硫酸亚铁铵晶体常含有Fe3+杂质。检验Fe3+的试剂可以用K4〔Fe(CN)6〕生成普鲁士蓝沉淀,有关的离子方程式是_________________________ _____。
(4)制得的晶体经过过滤后用无水乙醇洗涤而不用蒸馏水,理由是__________________;(任说两点)
(5)在25℃时,相同物质的量浓度的(NH4)2CO3、(NH4)2SO4、硫酸亚铁铵三种盐溶液a、b、c,其铵根离子浓度由小到大的排列顺序为_______________(用a、b、c回答)