42.40
根据数据计算0.1970g 样品中:n(Fe2+)==????????; n(C2O42—)==????????;
FeC2O4的质量分数为??????????????(精确到0.01%)
参考答案:(1)重复以上实验1—2次(2分)
(2)用高锰酸钾标
本题解析:(1)中和滴定实验为减少实验误差,一般要重复进行2-3次,取其平均值进行计算,这样可以减少误差,故步骤③也应该是再重复实验1-2次;(2)中和滴定操作的一般步骤是先检验活塞是否漏水,再洗涤,洗涤要先用蒸馏水洗,然后用待装的溶液润洗,以保证待装溶液的浓度不会被蒸馏水冲稀了,故这里要用待装的高锰酸钾标准溶液润洗滴定管;(3)加入锌粉和稀硫酸的目的是使铁离子还原成亚铁离子,所以是否合格的标准当然是看有无铁离子存在,没有铁离子存在即合格,否则就不合格,而检验铁离子的最好方法是加硫氰化钾,若溶液不变红,说明没有了铁离子,即合格;(4)设溶液中亚铁离子的物质的量为n1,草酸根离子的物质的量为n2,即有下列关系:
5Fe2+——————————MnO4—
5?????????????????????? 1
n1????????? (42.40-31.30)mL×10—3L/mL×0.02000mol/L
n1=0.001110mol
5C2O42———————————2MnO4—
5?????????????????????????? 2
n2?????????? (0.03130—0.01110)
n2=0.001010mol
w(FeC2O4)=0.001010mol×144g/mol÷0.1970g=73.81%
本题难度:一般
2、实验题 (12分)某校化学小组学生利用“废铁屑与水反应”的产物还原氧化铜,并制取FeCl3·6H2O晶体。(图中夹持、加热及尾气处理装置均已略去)
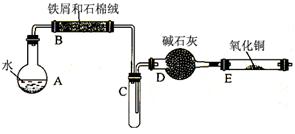
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用蒸馏水洗涤2~3遍,用滤纸吸干水分。
②将洗涤干燥后的废铁屑和石棉绒混合置于气密性良好的上述装置B中。
③先点燃X处的酒精灯,待试管C中出现大量水雾时,点燃Y处的酒精喷灯。
④经过必要的实验操作后,点燃Z处的酒精灯。
⑤停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。
⑥利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
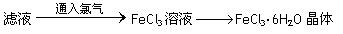
回答下列问题:
(1)实验步骤①的目的是????????????????????????????????????????????。
(2)步骤③X处是指???????(用图中的A、B、C……表示),待试管C中出现大量水雾时,点燃Y处的酒精喷灯的目的是:?????????????????????????????????。
(3)步骤④必要的实验操作是指:?????????????????????????????????????。
(4)步骤⑥从FeCl3溶液中得到FeCl3·6H2O晶体的主要操作包括:
????????????????????????????????????????????????????????????????????。
(5)这个流程中需保持盐酸过量,主要原因是:
??????????????????????????????????????????????????????????????????????。
参考答案:(每空2分,12分)
(1)除去废铁屑表面的油污(杂质
本题解析:略
本题难度:简单
3、填空题 在已经提取氯化钠、溴、镁等化学物质的富碘卤水中,采用下面的工艺流程生产单质碘:
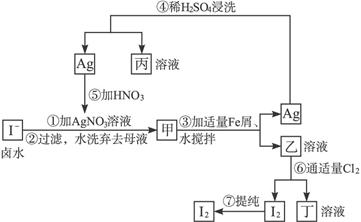
试完成下列问题:
(1)乙、丁中溶质的化学式:乙____________;丁____________。
(2)第④步操作中用稀H2SO4浸洗的目的是____________(填写字母编号)。
a.除去未反应的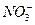 ???????????? b.除去未反应的I- ???????????? b.除去未反应的I-
c.除去未反应的Fe?????????????? d.除去碱性物质
(3)第⑦步操作可供提纯I2的一种方法是____________(不要求写具体步骤)。
(4)实验室检验I2的方法是________________________。
(5)甲物质见光易变黑,其原因是______________________________(用化学方程式表示)。
参考答案:(1)FeI2? FeCl3? (2)c? (3)升华或萃取
本题解析:富碘卤水中的I-与Ag+反应生成AgI(甲),AgI、铁粉在水中经不断搅拌,会缓慢发生反应,生成Ag和FeI2(即物质乙),在第④步加入稀H2SO4是溶解多余的铁粉而提纯银,再把银溶于硝酸,制取AgNO3,重新与I-反应。而乙溶液中通入适量Cl2,可生成FeCl3溶液(丁)和I2单质,用升华或萃取的办法提纯碘。
点评:本题考查了卤素及其化合物的特性、X-(卤离子)的检验等知识,考查了学生综合运用知识的能力。
可运用平衡移动的观点解释AgI、铁粉在水中的反应:AgI(s) Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。 Ag++I-,加入Fe粉2Ag++Fe====2Ag+Fe2+,使AgI的溶解平衡正向移动,AgI逐渐溶解生成FeI2和Ag。
本题难度:简单
4、选择题 下列装置可以用作实验室制取乙炔气体的反应装置的是
A.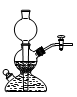
B.
C.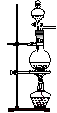
D.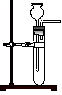
参考答案:B
本题解析:实验室利用碳化钙与食盐水常温下反应制取乙炔气体,不用酒精灯加热,排除C。因为该反应剧烈,放热多,而且生成的氢氧化钙呈糊状,易堵塞启普发生器或其简易装置的下端管口,故排除A、D。
故选B
本题难度:一般
5、选择题 可用下图装置制取(必要时可加热)、净化、收集的气体是
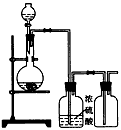 [???? ] [???? ]
A.铜和稀硝酸制一氧化氮
B.氯化钠与浓硫酸制氯化氢
C.锌和稀硫酸制氢气
D.硫化亚铁与稀硫酸制硫化氢
参考答案:B
本题解析:
本题难度:简单
|