微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 2SO2(g)+O2(g)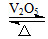 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是(双选) ( )。
A.催化剂V2O5可改变该反应的正、逆反应速率
B.增大反应体系的压强、反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1,t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=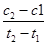
参考答案:AD
本题解析:B选项,若恒温恒容充入惰性气体,则反应体系的压强增大、而各物质浓度不变,反应速率不变;C选项,降低温度导致反应速率减小,延长反应达到平衡的时间。
本题难度:一般
2、选择题 对化学反应限度的叙述中错误的是( )
A.任何可逆反应在给定条件下的进程都有一定的限度
B.化学反应达到限度时,反应物的浓度和生成物的浓度不再改变
C.化学反应的限度决定了反应物在该条件下的最大转化率
D.化学反应的限度是不可改变的
参考答案:A.在一定条件下,当正逆反应速率相等时,可逆反应达到一定的限
本题解析:
本题难度:一般
3、选择题 最近,各国科学家联合研制成功一种新型催化剂,可在常压下将二氧化碳与氢气混合转化为甲烷。在VL容器中进行该转化,相关情况如图所示。下列有关说法不正确的是
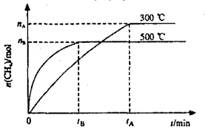
A.101KPa、120℃时,该反应的平衡常数表达式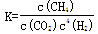
B.断裂lmolC=O、2molH—H所吸收的能量小于形成2molC—H、2molO—H所释放的能量
C.300℃时,从反应开始达到平衡的这段时间,化学反应速率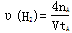
D.其它条件不变,减小容器体积,二氧化碳的平衡转化率增大,平衡常数不变
参考答案:A
本题解析:
试题分析:A、该反应的方程式为CO2(g)+4H2(g)  CH4(g)+2H2O(g),120℃,水为气态,可知表达式错误;B、由图可知,该反应放热,故反应物吸收的总能量小于放出的总能量,正确;C、速率的计算式,正确;D、正反应为体积减小的反应,减小体积,增大压强,平衡正向移动,故转化率增大,平衡常数只
CH4(g)+2H2O(g),120℃,水为气态,可知表达式错误;B、由图可知,该反应放热,故反应物吸收的总能量小于放出的总能量,正确;C、速率的计算式,正确;D、正反应为体积减小的反应,减小体积,增大压强,平衡正向移动,故转化率增大,平衡常数只
本题难度:一般
4、填空题 以CO2为碳源制取低碳有机物成为国际研究焦点,下面为CO2加氢制取乙醇的反应: 2CO2(g)+6H2(g)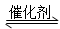 CH3CH2OH(g)+3H2O(g) -Q(Q>0)
CH3CH2OH(g)+3H2O(g) -Q(Q>0)
在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如下图所示。
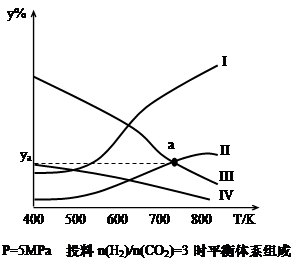
完成下列填空:
(1)表示CH3CH2OH体积分数曲线的是_______(选填序号)
(2)在一定温度下反应达到平衡的标志是_______(选填编号)
a.平衡常数K不再增大
b.CO2的转化率不再增大
c.混合气体的平均相对分子质量不再改变
d.反应物不再转化为生成物
(3)其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是_______(选填编号);达到平衡后,能提高H2转化率的操作是_______(选填编号)
a.降低温度???? b.充入更多的H2?
c.移去乙醇?? d.增大容器体积
(4)图中曲线II和III的交点a对应的体积分数ya=_______%
参考答案:(1)II(2分)
(2)bc(2分)?
(3)
本题解析:
试题分析:(1)反应过程中反应物逐渐减少,生成物逐渐增多,变化量的关系符合化学计量数比值,故Ⅰ、Ⅱ、Ⅲ、Ⅳ分别为H2O、CH3CH2OH、H2、CO2(g) ;
(2)遵循“变量不变达平衡”,a、温度不变平衡常数不变,错误;b、转化率从0到最大,是变量,不变时达到平衡,正确;c、气体的质量不变,容器的体积不变,混合气体的密度是定值,错误;d、平衡是动态平衡,每种物质的生成速率和消耗速率相等,错误;
(3)提高反应物的转化率可以改变温度使平衡正向移动,或增加另一种反应物的浓度,或移去产物
本题难度:一般
5、选择题 本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 (???)???????????????????????
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
参考答案:C
本题解析:
C不正确,化学反应速率理论是研究化学反应的快慢的理论,化学平衡研究提高原料转化率。其余正确,选C。
本题难度:一般