微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度时,把1molN2O4气体通入体积为5L的真空密闭容器中,立即出现棕色,反应进行4s时NO2的浓度为0.04mol/L,再经过一定时间后,反应到达平衡,这时容器内压强为开始时的1.6倍。
(1)、前4s中以N2O4的浓度变化表示的平均反应速度为????????????mol/L·s
(2)、在4s时容器内的压强为开始时的?????????倍
(3)、在平衡时容器内含N2O4??????????????mol
(4)、在平衡时容器内NO2的浓度为?????????????mol/L
(5)、N2O4的转化率为??????????????????
参考答案:0.005mol/L·s;1.1倍;0.4mol;0.24m
本题解析:反应进行到4秒时,NO2的浓度为0.04摩/升,则此时NO2的反应速率是0.01mol/(L·s)。由于速率之比是化学计量数之比,因此N2O4的浓度变化表示的平均反应速度为0.005摩/升·秒。4s时NO2的物质的量是0.2mol,消耗N2O4是0.1mol,所以此时体系内压强为开始时压强 。设平衡时生成NO2是
。设平衡时生成NO2是
本题难度:一般
2、选择题 在一定温度下,体积不变的密闭容器中可逆反应A(g)+3B(g)?2C(g)达到平衡的标志是( )
A.气体的密度不再变化
B.单位时间内生成n?molA,同时生成3n?molB
C.A、B、C的浓度不再变化
D.A、B、C的浓度之比为1:3:2
参考答案:A、由于A、B、C都是气体,ρ=
本题解析:
本题难度:一般
3、填空题 恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:2A(g)+B(g)?xC?(g)+D(s),10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol?L-1?s-1;40s时反应恰好处于平衡状态,此时B的转化率为20%.
(1)x=______;
(2)从反应开始到40s达平衡状态,A的平均反应速率为______;
(3)平衡时容器中B的体积分数为______;
(4)该温度下此反应的平衡常数表达式为______数值是______;
(5)下列各项能表示该反应达到平衡状态是______
A.消耗A的物质的量与生成D的物质的量之比为2:1 B.容器中A、B的物质的量?n(A):n(B)=2:1
C.气体的平均相对分子质量不再变化 D.压强不再变化 E.气体密度不再变化
(6)在相同温度下,若起始时c(A)=5mol?L-1,c(B)=6mol?L-1,反应进行一段时间后,测得A的浓度为3mol?L-1,则此时该反应是否达到平衡状态______(填“是”与“否”),此时v(正)______v(逆)(填“大于”“小于”或“等于”).
参考答案:(1)出A的物质的量变化量△n(A)=2mol-1.7mol
本题解析:
本题难度:简单
4、填空题 (8分)
(1)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应
????(填“是”或“否”)达到化学平衡状态,若未达到,向???? (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。
(2)对于可逆反应:aA(g) +bB(g)  cC(g)+dD(g)?△H = a kJ·mol
cC(g)+dD(g)?△H = a kJ·mol -1;
-1;
若增大压强平衡向正反应方向移动,则a+b????c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a_______0(填“>”或“<”)
参考答案:(1)否?逆反应?(2)>?>
本题解析:略
本题难度:一般
5、选择题 下列有关说法正确的是
A.准确称取0.4000 g NaOH固体可配成100 mL 0.1000 mol·L-1的NaOH标准溶液
B.催化剂可以加快化学反应速率但不能改变化学反应的焓变
C.100 mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱
D.对于反应2SO2(g)+O2(g)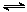 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
参考答案:BC
本题解析:
试题分析:A. NaOH在空气中易变质,不可能得到NaOH标准溶液,错误;B正确;C.HB放出的氢气多,说明其中含有较多的未电离的分子,说明HB酸性比HA弱,正确;D.平衡常数K只与温度有关,不会受压强的影响,错误;
本题难度:一般