微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将O2、NO、NH3、HCl分别收集于等体积的四个容器里,把四个容器用导管连成一个整体,若使各气体充分混合(保持温度 不
不 变),混合后容器中的压强与原容器中的压强之比为( )
变),混合后容器中的压强与原容器中的压强之比为( )
A.1:1
B.1:2
C.3:4
D.3:8
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下图是可逆反应X2 + 3Y2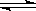 ?2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
?2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
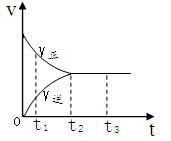
A.t1时,只有正方向反应
B.t2时,反应到达限度
C.t2- t3,反应不再发生
D.t2- t3,各物质的浓度不再发生变化
参考答案:BD
本题解析:
试题分析:A选项,在任何的适合,可逆反应都有正反应方向也有逆反应方向。B选项t2说明该反应达到了平衡的状态,即达到了限度。所以B选项是正确的。C选项,是动态平衡所以C选项是错误的。D选项,当达到平衡后,各物质的浓度保持不变。所以答案选BD
本题难度:一般
3、填空题 (12分)在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)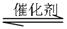 CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下
CO2(g)+H2(g),其化学平衡常数K和温度k的关系如下 表:
表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 1.7
| 1.1
| 1.0
| 0.6
| 0.4
回答下列问题:
(1)该反应的化学平衡常数表达式为K=??????????????????。该反应为???????反应(选填“吸热”、“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是???????????。
(a)容器中压强不变?????????????????????????????(b)混合气体中c(CO)不变
(c)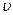 逆(H2)= 逆(H2)=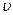 正(H2O)????????????????(d)c(CO2)=c(CO) 正(H2O)????????????????(d)c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡。在其他条件不变的情况下,缩小容器的体积。平衡??????????????移(选填“向正反应方向”、“向逆反应方向”、“不”)
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,CO的转化率为?????????????????。
参考答案:(1) 本题解析:略 本题解析:略
本题难度:简单
4、填空题 甲醇汽油是由10%一25%的甲醇与其他化工原料、添加剂合成的新型车用燃料,可达到国标汽油的性能和指标。甲醇是一种可再生能源,具有广泛的开发和应用前景。
Ⅰ、工业上合成甲醇一般采用下列反应:CO(g)+2 H2(g) CH3 OH(g) △H="a" kJ/mol, CH3 OH(g) △H="a" kJ/mol,
下表是该反应在不同温度下的化学平衡常数(K):
温度/0C
| 250
| 310
| 350
| K
| 2.041
| 0.250
| 0.012
?
(1)由表中数据判断△H? a???????0(填“>”、“=”或“<”)。
(2)某温度下,将2 mol CO和6 mol H2充入2 L的密闭容器中,充分反应达到平衡后,测得c(CO)="0.5" mol·L-1,则此时的温度为??????????0C。
(3)在容积固定的密闭容器中发生上述反应,各物质的浓度如下表:
???????浓度mol/L
时间/min
| c(CO)
| c(H2)
| c(CH3OH)
| 0
| 0.8
| 1.6
| 0
| 2
| 0.6
| 1.2
| 0.2
| 4
| 0.3
| 0.6
| 0.5
| 6
| 0.3
| 0.6
| 0.5
?
①反应从2 min到4 min之间,H2的反应速率为????????。
②反应达到平衡时CO的转化率为?????????????。
③反应在第2 min时改变了反应条件,改变的条件可能是????????(填序号)。
A.使用催化剂??? B.降低温度??? C.增加H2的浓度
(4)向容积相同、温度分别为T1和T2的两个密闭容器中均充入1 molCO和2 mol H2,发生反应CO(g)+2 H2(g)? ?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则 ?CH3 OH(g)△H="a" kJ/mol。恒温恒容下反应相同时间后,分别测得体系中CO的百分含量分别为w1和w2;已知T1<T2,则
w1??????w2(填序号)。
A.大于????B.小于????C.等于????D.以上都有可能
Ⅱ、甲醇在化学电源方面也有着重要应用。写出以甲醇为燃料,氢氧化钠溶液为电解质溶液的原电池中负极的电极反应式:?????????????????????????????????????????????。
参考答案:
Ⅰ(1)<(2分)
(2)310(2分)
本题解析:
试题分析:(1)温度升高,K值减小,平衡向左移动,负反应吸热,故正反应放热。
(2)反应结束后,由CO浓度知CO物质的量为1mol。故CO反应量为1mol,剩余CO为1mol,即0.5mol/L,依次推出,H2反应了2mol,剩余H2为4mol,即2mol/L,生成甲醇1mol,即0.5mol/L,此时,反应平衡,K值为0.5/(0.5*2*2)=0.25,为310℃的平衡常数。
(3)①H2物质的量从1.2mol/L,反应成为0.6mol/L,时间经过2分钟,故反应速率为0.3mol/(L*min)
②容积固定,由0.8mol/L,转化到0.3mol/L,转化量为0.5mol/L,转化率为0.5/0.8=0.625
③2~4min内的反应速率大于0~2min 内的反应速率。故排除B,对比CO浓度的变化,排除C。
(4)本题关键是时间。如果时间很短,未充分反应,那么温度高的反应快,CO量少。但如果充分反应后,温度高的,因为平衡向左移动,CO量较多。故都有可能。
(5)其实是甲醇的燃烧反应与二氧化碳被氢氧化钠吸收的和反应。负极失去电子,C由负二价变为正四价,失去6 个电子,已知右边生成CO32-,由电荷守恒,左边OH-,应为8个,水自然补平。但6不是4(O2吸收电子数)的整数倍,故,整体乘2.
本题难度:一般
5、选择题 下列说法正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.一定温度下,可逆反应2X (g)+Y (g)  2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2 2Z (g)达到平衡的标志是:容器内X、Y、Z的物质的量之比为2:1:2
C.升高温度,AgCl的溶解度增大,Ksp增大
D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均显酸性
参考答案:C
本题解析:
试题解析:A、溶液的导电能力与离子浓度、离子所带电荷的多少有关,与电解质的强弱无关,错误;B、一定条件下的可逆反应到达化学平衡时是指各物质的浓度保持恒定的状态,错误;C、溶解反应是吸热反应,当温度升高时,溶解平衡正向移动,离子浓度增大,平衡常数增大,正确;D、Na2CO3的水溶液显碱性,错误,答案选C。
本题难度:简单
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772