微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2(g)+I2(g) 2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
2HI(g);△H<0,有相同容积的密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入0.1mol H2和0.2molI2,相同温度下分别达到平衡。下列说法不正确的是
A.乙中反应速率比甲中反应速率快
B.平衡时甲、乙两容器中混合物的总物质的量之比为2︰3
C.若平衡时甲中H2的转化率为40%,则乙中H2的转化率大于40%
D.平衡后,向乙中再加入0.1mol H2,建立新的平衡时,甲和乙中H2的百分含量不相同
2、填空题 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
压强/kPa
| 13.33
| 53.32
| 101.3
|
K的沸点/℃
| 590
| 710
| 770
|
Na的沸点/℃
| 700
| 830
| 890
|
KCl的沸点/℃
| ?
| ?
| 1 437
|
NaCl的沸点/℃
| ?
| ?
| 1 465
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
3、选择题 一定温度下,可逆反应 A2(g)+3B2(g)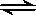 2AB3(g) 达到平衡的标志是 2AB3(g) 达到平衡的标志是
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时生成3mol B2
C.容器内A2、B2、AB3的物质的量之比为1:3:2
D.容器内A2、B2、AB3的物质的量浓度相等
4、选择题 将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)  ClF3(g);△H<0。下列叙述中,正确的是 ClF3(g);△H<0。下列叙述中,正确的是
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.6 倍
B.若 c(F2):c (ClF): c (ClF3) ="1:" 1: 1,则反应一定达到平衡状态
C.达到平衡后,若增大容器容积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
5、选择题 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。已知:CO2(g)+3H2(g)  ?CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是 ?CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1。下列叙述中不正确的是
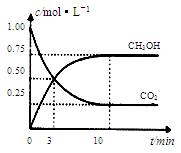
A.0~3 min内,v(CO2)正 =v (CH3OH)正
B.其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动
C.在T1℃时,若起始时向容器中充入2molCO2和6mol H2 , 测得平衡时容器内压强为P2, 则 P2<2P1
D.T2℃时,上述反应平衡常数为4.2,则T2>T1
|