微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 现有下列四个图象,下列反应中全部符合上述图象的反应是( )

A.N2(g)+3H2(g)?2NH3(g);△H<0
B.2SO3(g)?2SO2(g)+O2(g);△H>0
C.4NH3(g)+5O2(g)?4NO+6H2O(g);△H<0
D.H2(g)+CO(g)?C(s)+H2O(g);△H>0
参考答案:由第一个和第二个图象可知升高温度生成物的浓度增大,说明平衡向
本题解析:
本题难度:一般
2、选择题 100mL 6mol·L-1 H2SO4跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的
[???? ]
A.碳酸钠固体
B.水
C.硫酸钾固体
D.醋酸钠固体
参考答案:BD
本题解析:
本题难度:一般
3、实验题 (16分)Na2S2O8溶液可降解有机污染物4-CP,原因是Na2S2O8溶液在一定条件下可产生强氧化性自由基(SO4-)。通过测定4-CP降解率可判断Na2S2O8溶液产生(SO4-·)的量。某研究小组探究溶液酸碱性、Fe2+的浓度对产生(SO4-·)的影响。

(1)溶液酸碱性的影响:其他条件相同,将4-CP加入到不同pH的Na2S2O8溶液中,结果如图a所示。由此可知:溶液酸性增强,????????????????(填 “有利于”或“不利于”)Na2S2O8产生SO4-·。
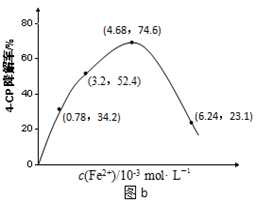
(2)Fe2+浓度的影响:相同条件下,将不同浓度的FeSO4溶液分别加入c(4-CP)=1.56×10-4 mol·L-1、c(Na2S2O8)=3.12×10-3 mol·L-1的混合溶液中。反应240 min后测得实验结果如图b所示。
已知 S2O82?- + Fe2+= SO4-·+ SO42- + Fe3+,此外还可能会发生:SO4-· + Fe2+=SO42- + Fe3+
① 实验开始前,检验FeSO4溶液是否被氧化的试剂是 ????????????(化学式)。如被氧化可以观察到的现象是?????????????????????。
②当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为??????%,4-CP降解的平均反应速率的计算表达式为????????????????????????????????。
③当c(Fe2+)过大时,4-CP降解率反而下降,原因可能是?????????????????????????。
参考答案:(1) 有利于???????????????????????
本题解析:
试题分析:⑴据图a分析,PH越小(酸性越强),4-CP的降解率增大,则Na2S2O8溶液产生SO4-的量增多,即溶液酸性增强,有利于Na2S2O8产生SO4-。
⑵①FeSO4溶液被氧化产生Fe3+,可向溶液中加入KSCN检验,若溶液变红说明FeSO4溶液已被氧化,反之,没有被氧化。
②据图b中的数据分析知,当c(Fe2+)=3.2 ×10-3 mol·L-1时,4-CP降解率为52.4%;则4-CP降解的平均反应速率的计算表达式为= 本题难度:一般
本题难度:一般
4、实验题 I.下列四支试管中,过氧化氢分解的化学反应速率最大的是????????
试管
| 温度
| 过氧化氢浓度
| 催化剂
|
a
| 室温(25℃)
| 12%
| 有
|
b
| 水浴加热(50℃)
| 4%
| 无
|
c
| 水浴加热(50℃)
| 12%
| 有
|
d
| 室温(25℃)
| 4%
| 无
II.某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
实验编号
| 反应物
| 催化剂
| ①
| 10mL2% H2O2溶液
| 无
| ②
| 10mL5% H2O2溶液
| 无
| ③
| 10mL5% H2O2溶液
| 1mL0.1mol·L-1FeCl3溶液
| ④
| 10mL5% H2O2溶液+少量HCl溶液
| 1mL0.1mol·L-1FeCl3溶液
| ⑤
| 10mL5% H2O2溶液+少量NaOH溶液
| 1mL0.1mol·L-1FeCl3溶液
(1)实验①和②的目的是____________________________。
(2)写出实验③的化学反应方程式??????????????????????????????。
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。
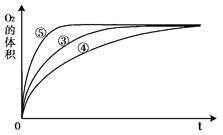
分析上图能够得出的实验结论是??????????_________________________。
参考答案:I.c(2分)
II.(1)探究浓度对反应速率的影响?
本题解析:
试题分析:I温度越大,化学反应速率越大,催化剂可以提高化学反应的反应速率,所以过氧化氢分解的化学反应速率最大的是c;
II.(1)①和②中所以的过氧化氢的浓度不同,其他条件相同,所以①和②的目的是探究浓度对反应速率的影响;(2)实验③采用了FeCl3作为催化剂,所以实验③的化学反应方程式为2H2O2
本题难度:一般
5、选择题 对于100mL 1mol/L盐酸与锌粒的反应,采取下列措施能使放出H2速率加快的是
①升高温度
②改用100mL 1mol/L硫酸
③多用300mL 1mol/L盐酸;
④用等量锌粉代替锌粒
⑤改用100mL 6mol/L硝酸
⑥滴入几滴硫酸铜溶液
⑦用粗锌代替纯锌使用
A.①③④⑤⑦
B.①②④⑥⑦
C.②③④⑤⑥
D.①②③⑥⑦
参考答案:B
本题解析:
试题分析:在其它条件不变的情况下,升高温度或增大氢离子的浓度可以加快反应速率,即①②正确,③不正确;增大反应物的接触面积,也可以加快反应速率,④正确;硝酸是氧化性酸,和金属反应得不到氢气,⑤不正确;滴入几滴硫酸铜溶液,锌可以置换出铜,从而构成铜锌原电池,加快反应速率,⑥正确;用粗锌代替纯锌使用,也可以构成铜锌原电池,加快反应速率,⑦正确,答案选B。
点评:该题是中等难度的试题,也是高考中的常见题型,试题综合性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于激发学生的学习兴趣和学
本题难度:一般
|
|