微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3- Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
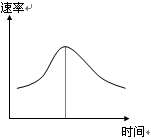
(1)反应开始时反应速率加快的原因是???????????????????;
(2)反应后期反应速率下降的原因是??????????????????????????????????????????????????????????????。
参考答案:
(1)反应开始时c(H+)曾加,ClO
本题解析:考查条件对反应速率的影响:浓度、温度、压强和催化剂等
(1)由题目所给信息可知,由于反应开始时生成了H+,ClO3-的氧化性随c(H+)的增大而增强,化学反应速率加快
(2)反应进行过程中,各反应物离子的浓度减小成为影响反应速率大小的主要因素,降低了反应速率
本题难度:简单
2、填空题 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列问题:
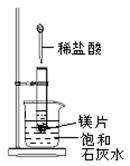
(1)(3分)实验中观察到的现象是__________________________
(2)(3分)产生上述现象的原因是_______________;
(3)(2分)写出有关的离子方程式:_______________________。
(4)(2分)由实验推知,MgCl2溶液和H2的总能量________(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
参考答案:(1)①镁片上有大量气泡产生②镁片逐渐溶解③烧杯中溶液变混浊
本题解析:在金属活动顺序表中镁位于氢的前面,和酸反应能置换出氢气。金属和酸的反应一般是放热反应,所以饱和石灰水的温度要升高,但氢氧化钙的溶解度随温度的升高而降低,所以会有晶体析出。反应放热,说明反应物的总能量高于生成物的总能量。
本题难度:一般
3、实验题 (9分)某学生用0.1×10×25mm3,质量分数≥99.5%的铝片和盐酸反应制取H2,实验现象见下表:

(1)写出铝片与盐酸、硫酸反应的离子方程式??????????????????????????????????
(2)反应1~15min内,铝与盐酸的反应速率逐渐加快,15~20min内,反应速率逐渐减小。其原因是????????????????????????????????????????????????????????????
(3)①根据铝片与盐酸和硫酸反应现象的差异,有学生对此现象提出如下猜想(至少要写出两种假设):
假设一:Cl-对该反应有促进作用,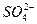 对该反应不影响。
对该反应不影响。
假设二:????????????????????????????????????????????????????????????。
假设三:????????????????????????????????????????????????????????????。]
假设四:????????????????????????????????????????????????????????????。
③?请你以“假设一”为实验课题,设计实验方案探究,要求写 出主要实验步骤。
出主要实验步骤。
???????????????????????来源:91考试网 www.91exAm.org?????????????????????????????????????????????
??????????????????????????????????????????????????????????????????
???????????????????????????????????????????????????????????????????
????????????????????????????????????????????????????????????????????
参考答案:
 本题解析:本题属于开放性试题,要求学生结合具体的实验情境,作出推断和假设,设问角度新颖,考查学生了解科学研究的基本思路和方法。(3)中答案也可能多种多样。如“
本题解析:本题属于开放性试题,要求学生结合具体的实验情境,作出推断和假设,设问角度新颖,考查学生了解科学研究的基本思路和方法。(3)中答案也可能多种多样。如“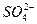 对金属铝与H+反应有抑制作用”或“
对金属铝与H+反应有抑制作用”或“ 本题难度:一般
本题难度:一般
4、选择题 工业上制硫酸的第二步反应:2SO2(g)+O2(g) 2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是
2SO3(g) △H<0,反应达到平衡后,改变某一个条件,下列示意图曲线①~⑧中正确的是

A.①⑥⑧
B.①⑤⑦
C.②③④
D.③⑥⑦
参考答案:B
本题解析:
试题分析:由于该反应是气体体积减小且放热的反应,所以当温度升高时,平衡逆向移动,平衡常数减小;使用催化剂对平衡移动没有影响,所以反应物转化率不变;平衡常数只受温度的影响,所以增加氧气的物质的量,平衡常数不变;压强增大,平衡向正反应方向移动,所以三氧化硫的物质的量浓度增大,所以图中①⑤⑦三条曲线是正确的,故选B;
考点:化学平衡专题
本题难度:一般
5、选择题 汽车尾气中的有毒气体NO和CO,在一定条件下可发生反应生成N2和CO2。下列关于此反应的说法中,正确的是(???? )
A.减小压强能增大反应速率
B.增大压强能减小反应速率
C.使用适当的催化剂能增大反应速率
D.升高温度对反应速率无影响
参考答案:C
本题解析:
试题分析:A.减小压强由于减小了反应物的浓度,所以使化学反应速率减慢,错误;B.增大压强能增大反应物的浓度,所以能增大反应速率,错误;C.使用适当的催化剂能改变反应途径,降低反应的活化能,所以能增大反应速率,正确;D.升高温度能够使反应速率大大加快,错误。
本题难度:一般