118
(1)海水显弱碱性的原因是(用离子方程式表示): ,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。
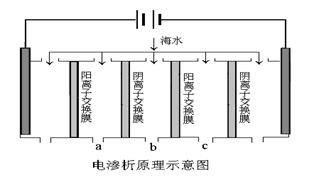
① 开始时阳极的电极反应式为 。
② 电解一段时间, 极(填“阴”或“阳”)会产生水垢,其成份为 (填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示 (填粒子符号),充电时该电极反应式为 。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为 (空气中氧气的体积分数按20%计)。
参考答案:(1)HCO3-+H2O 本题解析: 本题解析:
试题分析:(1)海水中含有碳酸氢根离子,水解显碱性,离子方程式为HCO3-+H2O H2CO3+OH-。根据表中数据可知该海水中Ca2+的物质的量浓度为 H2CO3+OH-。根据表中数据可知该海水中Ca2+的物质的量浓度为 4×10-3 mol/L。 4×10-3 mol/L。
(2)①电解池中阳极失去电子,发生氧化反应,因此开始时是海水中的氯离子放电,则开始时阳极的电极反应式为2Cl--2e-=Cl2↑。
②由于阴极是氢离子放电生成氢气,从而在阴极产生氢氧根,氢氧根与镁离子结合生成CaCO3和Mg(OH)2。产生的氢氧根还能与碳酸氢根反应生成碳酸根,因此还有碳酸钙沉淀产生,则电解一段时间,阴极会产生水垢,其成份为CaCO3和Mg(OH)2。
③在外加电流的作用下海水中的阴阳离子分别通过阴离子交换膜和阳离子交换膜移动,从而使1个间隔室的海水被淡化,而相邻间隔室的海水被浓缩,则根据装置图可知a和c是被浓缩的海水,则淡水的出口为b口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如右图所示:该电池电解质为能传导 Li+的固体材料。这说明锂是该电池的负极,失去电子,阳离子Li+向正极移动。则根据示意图可知左图中的小黑点表示Li+。充电是放电的逆反应,即该电极是阳极,阳极失去电子,则充电时该电极的反应式为LiFePO4-e-=FePO4+Li+ 。
(4)假设反应中得到1mol高锰酸钾,则由锰酸钾转化为高锰酸钾时锰元素的化合价从+6价升高到+7价,失去1个电子,则需要氯气0.5mol。得到1mol锰酸钾,其中锰元素的化合价从+4价升高到+6价,失去2个电子。氧气在反应中得到4个电子,则根据电子得失守恒可知需要氧气是0.5mol,因此氯气与氧气的体积之比是1:1。又因为氧气在空气中的体积份数是0.2,因此氯气与空气的体积比为1:5。
考点:考查海水资源的综合利用、氧化还原反应以及电化学原理的应用等
本题难度:困难
2、选择题 已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,
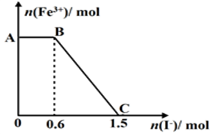
下列说法中不正确的是
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I- =2Fe2++I2
C.开始加入的K2Cr2O7为0.25 mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3。
参考答案:D
本题解析:
试题分析:A.开始时Fe3+浓度不变,则说明Fe3+没有参加反应,则AB应为K2Cr2O7和碘化钾的反应,K2Cr2O7为氧化剂,故A正确;B.BC段Fe3+浓度逐渐减小,为铁离子和碘化钾的反应,反应的离子方程式为2Fe3++2I-=2Fe2++I2,故B正确;C.由氧化剂和还原剂得失电子数目相等可知反应的关系式为K2Cr2O7~6Fe3+~6I-,共消耗的n(I-)=1.5mol,则开始加入的K2Cr2O7的物质的量为1.5mol÷6=0.25mol,故C正确;D.由方程式2Fe3++2I-=2Fe2++I2可知,BC段消耗KI0.9mol,则n(Fe3+)=n(Fe2+)=0.9mol,K2Cr2O7可与FeSO4反应的物质的量为0.25mol:0.9mol=5:18,故D错误,故选D。
考点:考查氧化还原反应的应用与计算
本题难度:一般
3、选择题 下列有关化学用语使用正确的是:(??)
A.CH4分子的比例模型: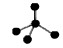
B.NH4Cl的电子式: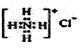
C.硫离子的离子结构示意图: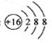
D.D聚丙烯的结构简式为: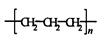
参考答案:C
本题解析:A不正确,这是甲烷的球棍模型。B不正确,氯离子的电子式不对,应该是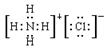 。聚丙烯的结构简式为 。聚丙烯的结构简式为 ,所以正确的答案选C。 ,所以正确的答案选C。
本题难度:一般
4、选择题 下列反应方程式中有一个与其他三个在分类上不同,这个反应是(??)
A.3Fe+2O2====Fe3O4
B.CO2+C====2CO
C.NH4HS====NH3+H2S
D.Na2CO3+CO2+H2O====2NaHCO3
参考答案:C
本题解析:ABD都是化合反应,C是分解反应,所以答案选C。
本题难度:简单
5、填空题 (6分)铁丝在氯气中点燃发生反应:2Fe + 3Cl2  2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。 2FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),氯元素被____ _____(填“氧化”或“还原”);Fe做_____ ____剂,具有 性。在该反应中,若消耗了1 mol Fe,则生成___ ____mol FeCl3,转移 mol电子。
参考答案:(6分)(每空1分)
降低, &
本题解析:
试题分析:根据2Fe + 3Cl2  2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。 2FeCl3反应,Cl元素的化合价反应前是0价,反应后是-1价,所以反应后降低;化合价降低,被还原;Fe元素的化合价反应前是0价,反应后是+3价,化合价升高,被氧化,作还原剂;具有还原性;在该反应中,若消耗了1 mol Fe,则生成1mol FeCl3,1个Fe失去3个电子,所以1molFe失去3mol电子,所以共转移3mol电子。
考点:考查氧化还原反应的分析,还原剂、氧化剂的判断,转移电子数的判断
本题难度:一般
|