微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 有pH=1的①盐酸②硫酸③醋酸
(1)设三种溶液的物质的量浓度分别为a、b、c,则其大小关系为???????????????。
(2)同体积的三种溶液与足量的NaOH溶液反应生成盐的物质的量分别为a、b、c,则其大小关系为??????????????。
(3)完全中和物质的量浓度和体积都相同的NaOH溶液时,需三种酸溶液的体积分别为a、b、c,则其大小关系为???????????????。
参考答案:(1)c>a>b??? (2)? c >a >b?? (3)
本题解析:因为硫酸是二元强酸,盐酸是一元强酸,醋酸是一元弱酸,所以在pH相等的条件下,物质的量浓度是c>a>b。
(2)由于酸的浓度大小顺序是c>a>b,所以生成的盐的大小顺序是c>a>b。
(3)在pH相等的条件下,强酸消耗的氢氧化钠相同,弱酸最多,即a=b>c
本题难度:一般
2、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。
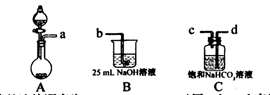
①各装置正确的连接顺序为 (用a、b、c、d表示)。
②检查整套装置气密性的方法是 。
③装置A中常用药品为 ;装置C中化学药品的作用是 。
(2)写出步骤三中发生反应的离子方程式 。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法 。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下:
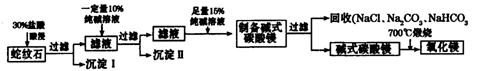
(1)过滤需要的玻璃仪器有 。
(2)沉淀Ⅱ的成分为 ,请用离子方程式表示生成沉淀的过程 (写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为 。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____ ,
参考答案:I.(1)①a 本题解析:
本题解析:
试题分析:I.根据题意知,该小组制备碳酸钠溶液的原理为:CO2(过量)+NaOH====NaHCO3,NaOH+NaHCO3====Na2CO3+H2O。(1)分析题给装置知,A为二氧化碳的发生装置,B中发生二氧化碳与氢氧化钠溶液的反应,C装置除去二氧化碳中的氯化氢;①为制得纯净的碳酸氢钠溶液,要先除去二氧化碳中的氯化氢,各装置正确的连接顺序为a d
d c
c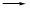 b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。 (2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。 (3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.根据题给流程分析,蛇纹石用30%盐酸酸浸,MgO、CaO、Fe2O3、Al2O3和盐酸反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O;而SiO2不与盐酸反应,过滤得沉淀Ⅰ为二氧化硅,滤液为MgCl2、CaCl2、FeCl3、AlCl3和盐酸的混合液,向滤液中加入一定量10%纯碱溶液,Ca2+、Fe3+、Al3+和碳酸钠溶液反应转化为氢氧化铁、氢氧化铝和碳酸钙沉淀经过滤而除去,反应方程式为CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;向滤液中加足量15%纯碱溶液制得碱式碳酸镁,过滤,回收氯化钠、碳酸钠和碳酸氢钠,碱式碳酸镁煅烧得氧化镁。(1)过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,用离子方程式表示生成沉淀的过程CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)纯碱溶液中所有离子浓度的大小关系为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)利用公式c=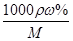 将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
考点:考查化学实验基本操作,物质的制备方案的设计、评价,物质的的分离提纯,离子方程式的书写,离子浓度大小比较,物质的量浓度的计算。
本题难度:一般
3、选择题 可以说明HCOOH是弱酸的事实是(???)
A.甲酸与水能以任意比混溶
B.甲酸能与Na2CO3溶液反应,生成CO2气体
C.1mol/L的HCOOH水溶液能使紫色石蕊试液变红
D.1mol/L的HCOONa溶液的pH约为8.5
参考答案:D
本题解析:考查弱电解质的判断。溶解性和电解质强弱无关,A不正确。B中只能说明甲酸的酸性强于碳酸的,B不正确。C是酸的通性,也不正确。甲酸钠溶液的pH大于7,说明甲酸钠水解显碱性。根据越弱越水解可判断甲酸属于弱电解质,所以正确的答案是D。
本题难度:一般
4、填空题 (1)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦NH4Cl,pH?由大到小的顺序为(填序号)______.
(2)将AlCl3溶于水后,经加热蒸发、蒸干,灼烧,最后所得白色固体的主要成分是______.
(3)、下列盐溶液能发生水解的用离子方程式表示,不能发生水解的写“不发生水解”字样,并说明溶液的酸碱性
K2CO3______.溶液呈______性;Na2SO4______溶液呈______性;CuCl2______.溶液呈______性.
参考答案:(1):酸:CH3COOH?是弱电解质,所以只有部分电离,故
本题解析:
本题难度:一般
5、填空题 某二元弱酸溶液按下式发生一级和二级电离:
H2A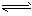 H++HA-
H++HA-
HA- H++A2-。
H++A2-。
已知相同浓度时的电离度,a(H2 A)>a(HA-),设有下列四种溶液:
A.0. 01mol/L的H2A溶液
B.0. 01mol/L的NaHA溶液
C.0. 02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D.0. 02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此填写下列空白(填代号):
(1)c(H+)最大的是____,最小的是____。
(2)c(H2A)最大的是____,最小的是____。
(3)c(A2-)最大的是____,最小的是____。
参考答案:(1)A ;D
(2)C ;D
(3)D ;
本题解析:
本题难度:一般