微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 向一个小烧杯中加入20克蔗糖,加3~4滴水,再加入20ml浓硫酸,观察到的实验现象是:烧杯发热、蔗糖变黑、体积膨胀,变成疏松多孔的海棉状的炭,并放出有制激性气味的气体。这个过程表现出浓硫酸的特性是???????????。
参考答案:吸水性、脱水性、强氧化性。
本题解析:本题能力层次为D,浓硫酸吸水会放出大量的热,为后面发生的反应提供热量,浓硫酸的脱水可以使蔗糖“炭化”,在受热的情况下浓硫酸和碳反应生成有刺激性气味的SO2气体。2H2SO4(浓)+C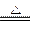 CO2↑+2SO2↑+2H2O。
CO2↑+2SO2↑+2H2O。
学法指导:浓硫酸有很强的吸水性,可以做干燥剂,吸水同时会放热;浓硫酸能按水的组成比脱去纸、
本题难度:简单
2、选择题 常温下,向20L真空溶器中通入amol H2S和bmol SO2 (a、b都是正整数,且a≤5,b≤5)反应完毕后,容器内气体可能达到的最大密度是( )
A.24.5g/L
B.14.4g/L
C.8g/L
D.5.1g/L
参考答案:B
本题解析:
【错解分析】这是一道计算类型的选择题。题中出现数据含字母,且有取值范围,若讨论最大密度,需考虑极值。
【正解】该题涉及的反应方程式为:2H2S+SO2=3S+2H2O,反应完毕后,在常温下,只能余H2S或SO2为气体。若余H2S,当a=5,b=1时,H2S余的最多,为1.5mol(51g);若余SO2,当a="1," b=5时,SO2余的最多,为4.5mol(288g)。体积相同的情况大,显然余SO2,余的越多,反应完毕后的气体密度越大。极限值为SO2 4.5mol。则 本题难度:简单
本题难度:简单
3、选择题 今有①HSO3—;②S2—;③SO32—;④HS——等四种溶液,向各种溶液中分别加入少量NaOH固体少量浓盐酸,几滴酸性高锰酸钾溶液,其离子数目都减少的是?????
A.①④
B.只有①
C.只有④
D.②③
参考答案:A
本题解析:
试题分析:向①中先加入氢氧化钠,则生成亚硫酸钠,然后加入盐酸,则生成SO2气体,所以溶液中离子数目减少;硫离子和氢氧化钠不反应,加入盐酸后,盐酸和氢氧化钠反应。最后加入酸性高锰酸钾溶液,则氧化硫离子,生成SO42—,离子数目不变;同样分析③中离子数目不变;向④中先加入氢氧化钠,则生成硫化钠,然后加入盐酸,则生成H2S气体,所以溶液中离子数目减少,答案选A。
点评:该题是高考中的常见题型,所以中等难度的试题。试题综合性强,再注重对学生基础性知识巩固和训练的同时,侧重对学生能力的培养和解题方法的
本题难度:简单
4、选择题 在Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中通入适量H2S,产生的沉淀物是
A.FeS和CuS
B.CuS
C.CuS和S
D.Al2S3、FeS和CuS
参考答案:C
本题解析:
试题分析:Fe2(SO4)3、CuSO4、Al2(SO4)3的混合溶液中氧化性离子的强弱顺序为Fe3+>Cu2+>Al3+,其中铁离子氧化H2S生成单质S沉淀,铜离子和硫离子反应生成硫化铜沉淀,铝离子和H2S不反应,有关反应的离子方程式是2Fe3++H2S=S+2H++2Fe2+、Cu2++H2S=CuS↓+2H+,所以最后生成的沉淀为CuS和S,答案选C。2S与硫酸盐反应产物的有关判断
本题难度:一般
5、选择题 下列关于SO2的说法中,错误的是(???? )
A.二氧化硫能漂白某些物质,说明它具有氧化性
B.二氧化硫的水溶液能使紫色石蕊溶液变红,说明它能与水反应生成H2SO3
C.实验室可用氢氧化钠溶液处理含有二氧化硫的尾气
D.将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,说明二氧化硫具有还原性
参考答案:A
本题解析:略
本题难度:简单