微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)近年来我国汽车拥有量呈较快增长趋势,NOx是汽车尾气中的主要污染物之一。
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
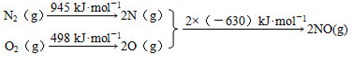
①写出该反应的热化学方程式 ,该反应的△S 0(填“>”、“<”或“=”);
②根据下图所示,只改变条件R,当N2的转化率从a3到a1时,平衡常数K 。

A.可能增大
B.一定不变
C.可能不变
D.可能减小
E.增大、减小、不变均有可能
(2)氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,达到新的平衡时,H2的转化率 (填“增大”、“减小”或不变,下同),N2的体积分数 。
(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放。某研究性学习小组用气体传感器测得不同时间NO和CO的浓度如下表:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
c(NO)(×10-4mol·L-1)
| 10.0
| 4.50
| 2.50
| 1.50
| 1.00
| 1.00
|
c(CO)(×10-3 mol·L-1)
| 3.60
| 3.05
| 2.85
| 2.75
| 2.70
| 2.70
请回答下列问题:
①写出反应的化学方程式 。
②前2 s内的平均反应速率ν(N2) = 。
参考答案:(1) ① N2(g)+O2(g)=2NO(g)
本题解析:
试题分析:(1)①由题可知,该反应的热化学方程式为:N2(g)+O2(g)=2NO(g) △H=(945+498-2×630)kJ/mol="+183" kJ/mol;该反应在高温下为自发进行故△G=△H-T△S<0,可知该反应△S>0;②根据右图所示,只改变条件R,当N2的转化率从a3到a1时,平衡正向移动,可采取措施:升高温度平衡常数K增大,或增大氧气量,平衡常数不变,故应选AC;(2) 氮气是合成氨的原料之一,合成氨反应:N2(g)+3H2 (g) 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,反应逆向进行达到新的平衡时,H2的转化率减小;N2的体积分数增大;(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放,①写出反应的化学方程式:2NO+2CO 2NH3(g) △H<0,500℃时将1molN2与1molH2充入容积为1L的密闭容器中发生反应,达到平衡后NH3的体积分数为20%。若升高温度至800℃,反应逆向进行达到新的平衡时,H2的转化率减小;N2的体积分数增大;(3)在汽车上安装高效催化转化器,将有毒气体转化为无毒气体,可有效降低NOx的排放,①写出反应的化学方程式:2NO+2CO N2+2CO2;②前2 s内的平均反应速率ν(NO) = N2+2CO2;②前2 s内的平均反应速率ν(NO) = mol/(L·s),则ν(N2)=1/2ν(NO)=1.88×10-4 mol/(L·s)。 mol/(L·s),则ν(N2)=1/2ν(NO)=1.88×10-4 mol/(L·s)。
考点:化学反应原理综合。
本题难度:困难
2、选择题 下列关于热化学反应的描述中正确的是( ? ) A.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ?mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-114.6kJ?mol-1
B.密闭容器中,9.6?g硫粉与11.2?g铁粉混合加热生成硫化亚铁17.6?g时,放出19.12?kJ热量,则Fe(s)+S(s)=FeS(s)△H=+95.6?kJ?mol-1
C.常温时H2(g)的燃烧热是285.8?kJ?mol-1,则2H2O(g)=2H2(g)+O2(g)△H=+571.6?kJ?mol-1
D.常温时葡萄糖的燃烧热是2800?kJ?mol-1,则1/2C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(?l?)△H=-1400?kJ?mol-1
参考答案:D
本题解析:
本题难度:简单
3、选择题 化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( ? )

A.N2(g)+3?H2(g)═2?NH3(l)△H=2(a-b-c)?kJ?mol-1
B.N2(g)+3?H2(g)═2?NH3(g)△H=2(b-a)?kJ?mol-1
C.
 ?N2(g)+ ?N2(g)+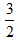 ?H2(g)═NH3(l)△H=(b+c-a)?kJ?mol-1 ?H2(g)═NH3(l)△H=(b+c-a)?kJ?mol-1
D.
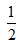 ?N2(g)+ ?N2(g)+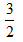 ?H2(g)═NH3(g)△H=(a+b)?kJ?mol-1 ?H2(g)═NH3(g)△H=(a+b)?kJ?mol-1
参考答案:A
本题解析:
本题难度:简单
4、选择题 白磷与氧可发生如下反应:P4+5O2="==" P4O10。已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ·mol-1、P-O:b kJ·mol-1、P=O:c kJ·mol-1、O=O:d kJ·mol-1,根据图示的分子结构和有关数据估算该反应的 H,其中正确的是( ) H,其中正确的是( )
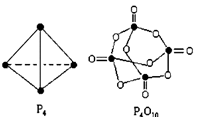
A.(6a+5d-4c-12b) kJ·mol-1
B.(4c+12b-6a-5d) kJ·mol-1
C.(4c+12b-4a-5d) kJ·mol-1
D.(4a+5d-4c-12b) kJ·mol-1
参考答案:A
本题解析:考查反应热的有关计算。反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据结构简式和方程式可知,该反应的反应热△H=(6a+5d-4c-12b) kJ·mol-1,答案选A。
本题难度:一般
5、选择题 1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为
[???? ]
A.C + H2O == CO + H2??? ΔH== +131.3kJ/mol
B.C(s)+ H2O(g) == CO(g) + H2(g)???ΔH== +10.94kJ/mol
C.C(s)+ H2O(l) == CO(g) + H2(g)?? ΔH== +131.3kJ/mol
D.C(s)+ H2O(g) == CO(g) + H2(g)???ΔH==? +131.3kJ/mol
参考答案:D
本题解析:
本题难度:简单
|
网站客服QQ: 960335752 - 14613519 - 791315772