微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (13分)碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。
(1)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:
I.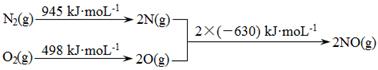
II.N2(g)+ O2(g)  2NO(g) ΔH1
2NO(g) ΔH1
2CO(g) + O2(g) 2CO2 (g) ΔH2=" -565" kJ·mol-1
2CO2 (g) ΔH2=" -565" kJ·mol-1
①ΔH1= 。
②在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式
③一定条件下,单位时间内不同温度下测定的氮氧化物转化率如图1所示。
温度高于710K时,随温度的升高氮氧化物转化率降低的原因可能是
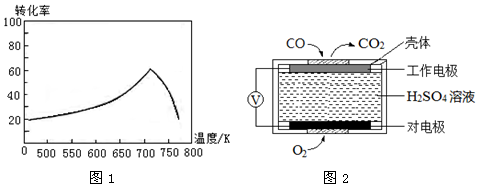
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中CO传感器的工作原理如图2所示,则工作电极的反应式为
②方法2:氧化还原滴定法。用H2O2溶液吸收尾气,将氮氧化物转化为强酸,用酸碱中和滴定法测定强酸浓度。写出NO与H2O2溶液反应的离子方程式
(3)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是,用文字和化学用语解释原因 。
2、填空题 (15分)I.研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,同温度下涉及如下反应:
a、2NO(g)+Cl2(g)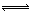 2ClNO(g) ?H1<0 其平衡常数为K1
2ClNO(g) ?H1<0 其平衡常数为K1
b、2NO2(g)+NaCl(s)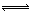 NaNO3(s)+ClNO(g) ?H2<0 其平衡常数为K2
NaNO3(s)+ClNO(g) ?H2<0 其平衡常数为K2
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g) ?H3的平衡常数K= (用K1、K2表示)。?H3= (用?H1、?H2表示)。
2NaNO3(s)+2NO(g)+Cl2(g) ?H3的平衡常数K= (用K1、K2表示)。?H3= (用?H1、?H2表示)。
(2)为研究不同条件对反应a的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应a达到平衡。测得10min内υ(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率α1= 。其它条件保持不变,反应(1)在恒压条件下进行,平衡时NO的转化率为α2,α1 α2(填“>”“<”或“=”),平衡常数K1 (填“增大”“减小”或“不变”)。若要使K1减小,可采用的措施是 。
II.第三代混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液.镍氢电池充放电原理示意如图:

其总反应式为H2+2NiOOH 2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
2Ni(OH)2 。根据所给信息判断,混合动力车上坡或加速时,甲电极周围溶液的pH (填“增大”“减小”或“不变”), 乙电极的电极反应式 。
3、选择题 已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ( )
A.Q1+ Q2+Q3
B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3
D.1.5Q1-0.5Q2+0.5Q3
4、填空题 (1)已知:H2(g)+O2(g) H2O(g),反应过程中能量变化如图所示,则:
H2O(g),反应过程中能量变化如图所示,则:

①a、b、c分别代表什么意义?
a ;
b ;
c 。
②该反应是 反应(填“吸热”或“放热”),ΔH
反应(填“吸热”或“放热”),ΔH 0(填“>”或“<”)。
0(填“>”或“<”)。
(2)发射“天宫”一号的火箭使用的推进剂是液氢和液氧,这种推进剂的优点是 , 。(请写两条)
(3)已知:H2(g)+O2(g) H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
H2(g) H2(l) ΔH=-0.92 kJ·mol-1
H2(l) ΔH=-0.92 kJ·mol-1
O2(g) O2(l) ΔH=-6.84 kJ·mol-1
O2(l) ΔH=-6.84 kJ·mol-1
H2O(l) H2O(g) ΔH=+44.0 kJ·mol-1
H2O(g) ΔH=+44.0 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式: 。
5、选择题 已知:H2(g)+F2(g)=2HF(g) △H=- 270 kJ·mol-1,下列说法不正确的是?
[???? ]
A.44.8 L氟化氢气体分解成22.4 L的氢气和22.4 L的氟气吸收270 kJ热量
B.1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量大于270 kJ
C.相同条件下,1 mol氢气与1 mol氟气的能量总和高于2mol氟化氢气体的能量
D.2 mol H-F键的键能比1mol H-H键和1mol F-F键的键能之和小270 kJ