微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 反应2A(g)+B(g)2C(g);△H>0。下列反应条件有利于生成C的是(??)
A.低温、低压
B.低温、高压
C.高温、高压
D.高温、低压
参考答案:C
本题解析:该反应的正反应为气体总体积减小的吸热反应,因此高压、高温有利于C的生成,故选C。
本题难度:一般
2、选择题 在一定温度下,反应:2A(s)+2B(g)  C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是(??)
C(g)+D(g)在恒容容器中进行,不能说明该反应已经达到平衡的是(??)
A.混合气的密度不再随时间而变化
B.C的质量不再改变
C.容器内的压强不随时间而变化
D.单位时间内生成2a mol B,同时生成a molD
参考答案:C
本题解析:考查化学平衡状态的判断。密度是混合气的质量和容器容积的比值,容器容积不变,但混合气的质量是变化的,所以A是可以说明的。C是气体,当质量不再变化,即说明其浓度不再变化,因此B可以说明。因为反应前后气体的体积是不变的,所以其压强始终是不变的,C不能说明.选项D中的反应速率方向是相反的,且满足速率之比是相应的化学计量数之比,因此也可以说明。答案选C。
本题难度:简单
3、填空题 (12分)已知2SO2 (g)+ O2(g)  2SO3(g)?△H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考
2SO3(g)?△H =-196kJ·mol-1,5000C时将2mol SO2和1molO2装入一体积恒定的10L密闭容器中,2分钟(t1)时达到平衡。如下图所示:高考
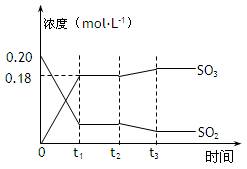
请回答下列问题:
(1)用O2表示2分钟内该反应的平均反应速率为???????????mol·L-1·min-1。计算500℃时该反应的平衡常数K=???????????。
(2)上图表示该反应在时刻t1达到平衡后,时刻t2因改变某个条件而发生变化的情况:
图中时刻t2发生改变的条件可能是???????????(写一个即可)。
(3)在上述条件下起始装入的SO2和O2各2mol,达平衡后设SO2的转化率为x,列出求x的方程???????????。(不必求出x)
(4)某温度时,该反应的平衡常数K 91eXaM.org=5000,则该温度????500℃(填“>”、“<”、“=”)。
(5)500℃时,若起始装入的SO2、O2和SO3分别为0.2mol、y mol、wmol,达到平衡时各组分的含量与第(3)完全相同,则y=??????mol。刚开始时反应向???????(填“正”或“逆”)反应方向进行。
参考答案:共12分
(1)0.045mol﹒L-1﹒min-1
本题解析:略
本题难度:一般
4、计算题 如图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量Na2O2,从A处缓缓通入CO2气体。恒温下,容器甲中活塞缓慢由B向左移动,当移至C处时,容器体积缩小至最小,为原体积的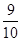 。随着CO2的继续通入,活塞又逐渐向右移动。
。随着CO2的继续通入,活塞又逐渐向右移动。

(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g。此时,通入标准状况下的CO2气体多少升?容器甲中NO2转化为N2O4的转化率是多少?
②活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至B处,则a值必小于0.01。其理由是_________________________________________________________________________。
(2)若改变干燥管中Na2O2的量,可通过调节甲容器的温度及通入CO2的量,使活塞发生从B到C,又从C到B的移动。则Na2O2的质量最小值应大于______________g。
参考答案:(1)①1.792 L,25%
②活塞移至C,体积不会
本题解析:①设通入标准状况下CO2气体的体积为x,产生氧气的体积为y。
2Na2O2+2CO2====2Na2CO3+O2?????Δm
2×22.4 L????? 22.4 L? 56 g
x????????????? y?????? 2.24 g
56 g·x=2×22.4 L×2.24 g? x="1.792" L
y="0.896" L? n(O2)="0.04" mol
2NO????? +????? O2? ="===?" 2NO2
2?????????????? 1???????? 2
0.1 mol>0.08 mol? 0.04 mol? 0.08 mol
所以NO过量,生成NO2的物质的量为0.08 mol。
所以2NO2 N2O4???Δn
N2O4???Δn
2??????????????? 1
0.02 mol?????????? 0.1 mol×(1-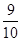 )
)
所以NO2转化为N2O4的转化率为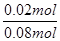 ×100%=25%
×100%=25%
(2)解:实现从B→C的移动,只能通过降温使2NO2 N2O4的平衡向右移动(此反应为放热反应)。
N2O4的平衡向右移动(此反应为放热反应)。
即降温时? 2NO2 N2O4???Δn
N2O4???Δn
2??????? 1?????? 1
0.02 mol?? 0.1 mol×(1-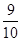 )
)
即容器中至少应有0.02 mol的NO2,根据转化关系式可知:
2Na2O2—O2—2NO—2NO2
至少需要Na2O2? 0.02 mol
所以其质量最小值为0.02 mol×78 g·mol-1="1.56" g。
同步测控
本题难度:简单
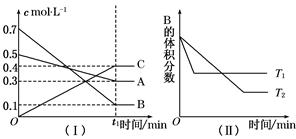
5、选择题 T ℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
A.在(t1+10) min时,其他条件不变,增大压强,平衡向逆反应方向移动
B.(t1+10) min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T ℃时,在相同容器中,若由0.3 mol·L-1A、0.1 mol·L-1 B和0.4 mol·L-1 C反应,达到平衡后,C的浓度仍为0.4 mol·L-1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
参考答案:C
本题解析:图(Ⅰ)是c-t图,根据A、B浓度分别减少0.2 mol·L-1、0.6 mol·L-1,C的浓度增大0.4 mol·L-1,则反应方程式为A+3B 2C,A选项:增大压强,平衡右移,A错误;B选项:保持总压不变,通入稀有气体,平衡左移,B错误;C选项此时各物质浓度与原平衡相等,正确;D选项:由图(Ⅱ)可知T1>T2,且温度升高,B的体积分数增大,平衡左移,所以正反应方向为放热反应,A的转化率减小,D错误。
2C,A选项:增大压强,平衡右移,A错误;B选项:保持总压不变,通入稀有气体,平衡左移,B错误;C选项此时各物质浓度与原平衡相等,正确;D选项:由图(Ⅱ)可知T1>T2,且温度升高,B的体积分数增大,平衡左移,所以正反应方向为放热反应,A的转化率减小,D错误。
本题难度:简单