微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g)???" ??????? △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g)?? △H=-92.4kJ/mol
2NH3(g)?? △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)?????? △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H=?????????????kJ/mol

(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
2、填空题 右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
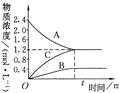
(1)该反应的反应物是???????????????????。
(2)该反应的化学方程式是:???????????????????????????????????。
(3)若达到平衡状态的时间为2min,则A的平均速率是????????????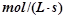 。
。
3、选择题 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2在相同温度下发生反应:2SO2(g)+O2(g)
 2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A.等于p%
B.大于p%
C.小于p%
D.无法判断
4、选择题 (14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
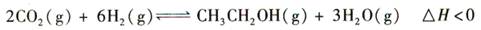
请回答:
(1)该反应的化学平衡常数表达式为?????????????????????????????????。
(2)当温度T1>T2时,化学平衡常数K1???????????K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是???????(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有??????????????????????????(写出一条合理措施即可)。
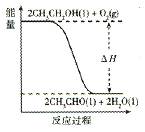
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是??????????????反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为????????????????????????????????。
5、填空题 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2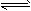 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通入过量的
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通入过量的
NaOH溶液,气体体积减小了21. 28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减小了5. 6L。(以上气体体积均为标准状况下的体积)(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.SO2和SO3浓度相等 b.SO2的百分含量保持不变 c.容器中气体的压强不变
d.SO3的生成速率和SO2的消耗速率相等 e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是____(填字母)。
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率____________(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?