微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 (8分)利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
(1)已知:N2(g)+O2(g)="2NO(g)???" ??????? △H=+180.5kJ/mol
N2(g)+3H2(g )
) 2NH3(g)?? △H=-92.4kJ/mol
2NH3(g)?? △H=-92.4kJ/mol
2H2(g)+O2(g)=2H2O(g)?????? △H=-483.6kJ/mol
完成氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式:
4NH3(g)+5O2(g)==4NO(g)+6H2O(g);△H=?????????????kJ/mol

(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对反应N2(g)+3H2(g)
 2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g)的影响.实验结果如图所示:(图中T表示温度,n表示物质的量)
①图像中T1和T2的关系是:T1_______T2(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最低的是________(填字母).
(3)在一定温度和催化剂下,将3.2mol H2和1.2molN2混合于一个容积为2L的密闭容器中发生反应,在2min末时反应恰好达平衡,此时生成了0.8mol NH3.计算该条件下的平衡常数。(写出计算过程,结果保留小数点后一位)
参考答案:(8分)
(1)-905 (2分)
(2)①高于
本题解析:略
本题难度:简单
2、填空题 右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
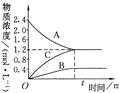
(1)该反应的反应物是???????????????????。
(2)该反应的化学方程式是:???????????????????????????????????。
(3)若达到平衡状态的时间为2min,则A的平均速率是????????????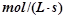 。
。
参考答案:(1)A??(2)3A 本题解析:
本题解析:
试题分析:(1)根据图像可知,A物质的浓度降低,所以A物质是反应物。
(2)平衡时A的浓度减少了2.4mol/L-1.2mol/L=1.2mol/L,B和C的浓度分别增加了0.4mol??????? /L和
1.2mol/L,则根据浓度的变化量之比是相应的化学计量数之比可知,反应的化学方程式是3A 3C + B。
3C + B。
(3)反应速率通常用单位时间内浓度的变化量来表示,则A的平均速率是1.2mol/L÷2min=0.6mol/(L·min)。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养。有利于调动学生的学习兴趣,提高学生应试能力和学习效率。该题的关键是在明确图像中曲线变化的基础上,灵活运用即可。
本题难度:一般
3、选择题 体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2在相同温度下发生反应:2SO2(g)+O2(g)
 2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
2SO3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )
A.等于p%
B.大于p%
C.小于p%
D.无法判断
参考答案:B
本题解析:略
本题难度:一般
4、选择题 (14分)乙醇是重要的化工原料和液体燃料,可以在一定条件下利用CO2与H2反应制得:
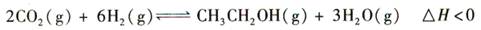
请回答:
(1)该反应的化学平衡常数表达式为?????????????????????????????????。
(2)当温度T1>T2时,化学平衡常数K1???????????K2(填“>”、“<”或“=”)。
(3)在恒温、恒容的密闭容器中,下列描述能说明上述反应已达化学平衡状态的是???????(填字母序号)。
a.生成1molCH3CH2OH的同时生成3 mol H2O
b.容器中各组分浓度不随时间而变化
c.容器中混合气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
(4)在工业生产中,可使H2的转化率和化学反应速率同时提高的措施有??????????????????????????(写出一条合理措施即可)。
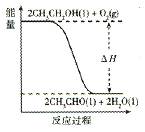
(5)工业上,常以乙醇为原料生产乙醛。根据下图所示信息,该反应是??????????????反应(填“放热”或“吸热”),判断依据是__________________。
(6)乙醇可以作为燃料电池的燃料。某乙醇燃料电池以乙醇为燃料,使用酸性电解质,该电池负极反应的电极反应式为????????????????????????????????。
参考答案:(1) 本题解析:
本题解析:
试题分析:(1)根据化学平衡常数表达式的书写原则,该反应的化学平衡常数表达式见答案;(2)该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡常数减小,即温度越高,平衡常数越小,温度T1>T2,K1<K2;(3)a.利用正逆反应速率相等作为平衡标志,注意“双向同时,符合比例”,生成1mol?CH3CH2OH的同时,生成3mol?H2O,都表示正反应速率,不能说明到达平衡,错误;b.可逆反应到达平衡时,各组分的物质的量不变,体系中各组份的物质的量浓度不随时间而变化,说明到达平衡,正确;c.反应混合气体的总质量不变,容器的体积不变,密度始终不变,体系中混合气体的密度不随时间而变化,不能说明到达平衡,错误;d.随反应进行混合气体总的物质的量减小,体系中气体的分子总数减少,体系中气体分子总数不随时间而变化,说明到达平衡,正确;选bd;(4)改变条件加快反应速率,同时平衡向正反应移动,可以增大CO2浓度或增大压强,反应速率加快,平衡向正反应移动氢气的转化率增大;(5)由图象可知,反应物的总能量大于生成物的总能量,故该反应物为放热反应;(6)燃料电池负极反应氧化反应,乙醇在负极放电,酸性条件下生成二氧化碳与氢离子,电极反应式为:CH3CH2OH-12?e-+3H2O=2CO2+12H+。
本题难度:一般
5、填空题 将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O2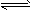 2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通入过量的
2SO3(正反应放热)。反应达到平衡后,将容器中的混合气体通入过量的
NaOH溶液,气体体积减小了21. 28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减小了5. 6L。(以上气体体积均为标准状况下的体积)(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是________(填字母)。
a.SO2和SO3浓度相等 b.SO2的百分含量保持不变 c.容器中气体的压强不变
d.SO3的生成速率和SO2的消耗速率相等 e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是____(填字母)。
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.升高温度
(3)求该反应达到平衡时SO2的转化率____________(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
参考答案:(1)bc
(2)b
(3)94.7%
本题解析:
本题难度:一般