1.2
请填写下列空白:
(1)该反应方程式可表示为???????????????????????????;反应达平衡时,A的转化率为????????????????????。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为?????????????;25℃时,反应的化学平衡常数K值为_____________。
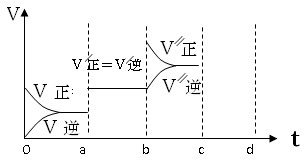
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是????????????????????????????;b c过程中改变的条件可能是????????????????????????????。
(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是?????????(填序号):
①2 mol A+6 mol B??②2mol C??③4mol C??④0.5 mol A+1.5mol B+1 mol C
参考答案:(每空2分,共14分)
(1)A(g) + 3B(g)
本题解析:(1)根据表中数据可知,2min后A的浓度减少0.6mol/L,B的浓度减少1.8mol/L,而C的浓度增加1.2mol/L,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的方程式是A(g) + 3B(g) 2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。 2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。
(2)2min内物质A的浓度变化了0.6mol/L,所以反应物A的平均反应速率为0.6mol/L÷2min=0.3 mol/(L﹒min)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是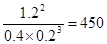 。 。
(3)根据图像可知,a b过程中正逆反应速率都是增大的,但平衡不移动。由于反应是体积减小的可逆反应,所以改变的条件只能是使用了催化剂;b c过程中逆反应速率逐渐增大,而正反应速率突然增大,然后逐渐再降低,平衡向正反应方向移动,所以改变的条件是增加A或B(或反应物)浓度。
(4)由于反应过程中容器容积和温度是不变的,则要使平衡等效,则根据化学方程式换算之后最初的A和B的物质的量必须分别等于1mol和3mol。2molC就相当于是1molA和3molB,题意选项④正也相当于是1molA和3molB,而选项①和③是等效的,因此正确的答案选②④。
本题难度:一般
2、选择题 反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少了0.6mol/L。关于此反应速率的说法正确的是[???? ]
A.用A物质表示的反应速率是0. 4mol/(L·min)
B.用C物质表示的反应速率是0. 2mol/(Lmin)
C.在2min末的反应速率,用B物质表示是0.3mol/(L·min)
D.在2min内用B物质和C物质表示的反应速率的值都是逐渐减小的
参考答案:BC
本题解析:
本题难度:一般
3、选择题 在反应:Fe2(SO4)3+6KSCN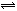 2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是: 2Fe(SCN)3+3K2SO4达到平衡后,加入少量下列固体物质,该平衡几乎不发生移动的是:
A.KSCN
B.K2SO4
C.NaOH
D.FeCl3。
参考答案:B
本题解析:【分析预测及备考建议】化学平衡在高考中主要从两方面进行考查,一方面是定性考查平衡的移动,即在改变条件时,定性解析平衡移动的原理,另一方面是定量的计算,如反应方程式系数的确定、反应进行的程度等。
【答题技巧】写出该反应的离子方程式:Fe3++3SCN-=Fe(SCN)3可知, K+、SO42-实际与反应无关,而加入KSCN时可增大KSCN 、FeCl3的浓度,平衡正向移动;加入NaOH时可与Fe3+反应生成Fe(OH)3沉淀,使Fe3+减少,平衡逆移。
本题难度:一般
4、选择题 在密闭容器中,对于可逆反应A+3B 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是

A.若正反应方向ΔH<0,则T1<T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
参考答案:AC
本题解析:如果正反应是放热反应,则升高温度平衡逆反应方向移动,C的体积分数降低,A正确。根据图像可知,随着压强的增大,C的体积分数是增大,说明正反应是体积减小的可逆反应,增大压强平衡向正反应方向移动,所以B一定是气体,C正确。B不正确,压强增大时,混合气体的平均相对分子质量增大。D不正确,物质A不一定是气体。答案选AC。
本题难度:一般
5、选择题 工业制备纯硅的反应:SiCl4 (g)+2H2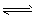 (g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 [???? ] (g)Si(s)+4HCl(g) △H =Q(Q>O),某温度、压强下,将一定量的反应物通入密闭容器进行以上反应,下列叙述正确的是 [???? ]
A.只要时间足够长,SiCl4可完全转化为Si
B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为Q
C.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)
D.当反应吸收热量为0. 025QkJ时,生成的HCl通入100mL 1mol·L-1的NaOH中恰好反应
参考答案:D
本题解析:
本题难度:一般
|