微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:
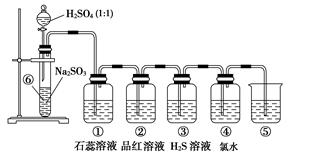
(1)⑥中发生的化学反应方程式为______________________________________(2分)
(2)⑤的作用是_______________________________________________________(2分),
反应的离子方程式为___________________________________________________(2分)
(3)填表格(每空1分)
装置
| 实验现象
| 体现SO2的性质
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
|
④
| ?
| ?
参考答案:(1)Na2SO3+H2SO4===Na2SO4+H2O+S
本题解析:
试题分析:(1)硫酸和亚硫酸钠反应生成SO2,则⑥中发生的化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑。
(2)SO2是大气污染物,因此氢氧化钠溶液的作用是吸收过量的SO2,防止污染环境,反应的离子方程式为SO2+2OH-=SO+H2O。
(3)SO2是酸性氧化物,溶于水显酸性,石蕊试液变红色;SO2具有漂泊性,能使品红溶液褪色;SO2具有氧化性,能把H2S氧化生成单质S沉淀;另外SO2还具有还原性,能被氯水氧化,使氯水褪色。2的制备、SO2性质的检验以及尾气处理
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生实验能力的培养和解题方法的指导,有助于培养学生规范、严谨的实验设计和评价能力。该类试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。
本题难度:一般
2、实验题 (14分)
I.仅用下列装置,检验木炭和浓硫酸反应产生的混和气体中含有SO2和CO2。在下列表格中填写对应的药品和实验现象。
实验装置
| 检验气体
| 试剂名称
| 实验现象
| A
| SO2
| ?
| ?
| B
| CO2
| ?
| ?
II.利用下列装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。

(1)将上面各仪器连成一整套装置,各种仪器接口的连接顺序(填编号)是:A接______________,B接______________。
(2)请写出铁棒电极上发生的电极反应式__________________________。
(3)能说明氯气具有氧化性的实验现象是_______________________________。
(4)若U管中装入的饱和食盐水为50mL(电解前后溶液体积变化可忽略),当收集到的氢气为5.6mL(标准状况)时停止通电,摇匀U型管内的溶液,取20.00mL该溶液于锥形瓶内,用0.01mol/L的盐酸滴定时,滴定管起始读数为1.00mL,滴定终点时,滴定管的读数为_______ mL。
参考答案:I.(4分,每空1分)足量的高锰酸钾(H+)溶液?紫色变浅?
本题解析:本题是综合性实验题。(1)SO2和CO2都为酸性氧化物,化学性质上有相似性,化合价虽然都为+4价,C为最高价只有氧化性,而S为中间价,既有氧化性又有还原性。据此可用SO2的还原性(使酸性的高锰酸钾褪色)或者用SO2的漂白性(使品红褪色)检验。(2)电解产生2Cl?-2e-=Cl2,发生在阳极,故阳极不能用铁(活性电解),铁做阴极,发生:2H++2e-=H2↑
本题难度:一般
3、选择题 下列实验正确的是
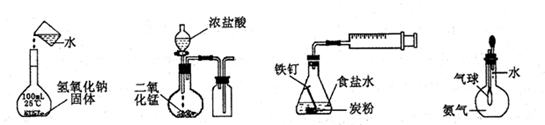
A.配制一定浓度溶液
B.制取并收集Cl2
C.铁的析氢腐蚀
D.验证氨气易溶于水
参考答案:D
本题解析:
试题分析:氢氧化钠固体不能直接倒入100mL容量瓶中溶解,应先在烧杯中溶解、冷却至25℃时,才能移入容量瓶中,且移液时一定要使用玻璃棒引流,故A错误;实验室常用二氧化锰和浓盐酸混合加热制取氯气,必须使用酒精灯加热,氯气的密度比空气大,必须用长进短出排气法收集,短进长出不能赶走集气瓶中的空气,故B错误;NaCl(食盐)是强酸强碱盐,食盐水呈中性,则铁、碳、中性电解质溶液形成原电池,发生吸氧腐蚀,在酸性环境中才可能发生析氢腐蚀,故C错误;氨气极易溶于水,瓶内气体压强迅速减小,瓶内外气体出现很大的压强差,若气球体积迅速增大,说明氨气易溶于水,故D正确。
本题难度:简单
4、实验题 如下图是甲同学设计的证明CO具有还原性的实验装置。

回答下列问题:
(1)实验时应先点燃___(填“A”或“B”)处的酒精灯。
(2)洗气瓶中的现象为________。
(3)酒精灯B的作用是____。
(4)乙同学提出甲设计太复杂,可将酒精灯合二为一,去掉B 而将尾气导管口旋转到A的火焰上即可,乙同学设计是否合理?____;理由是________。
(5)丙同学质疑CO能否使澄清石灰水变浑浊,因此其设计在CO通入CuO之前应先通过澄清石灰水以排除CO与澄清石灰水反应,试对此做出评价,你认为丙的设计____ (填“必要”或“不必要”)理由是________。
(6)丁同学认为甲设计的装置中尾气处理还可以用其他方法,请你为丁同学设计一种合理的尾气处理方法:___。
参考答案:(1)B
(2)澄清石灰水变浑浊
(3)将未反
本题解析:
本题难度:一般
5、简答题 锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下:

(1)写出上述各步反应的化学方程式①______;②______;③______;④______.
(2)提取过程中①至③的作用是什么?从节约资源角度考虑哪一步的产物可以循环使用?
参考答案:(1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧
本题解析:
本题难度:一般
|
|