微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 用硝酸氧化淀粉水解的产物(C6H12O6)可制得少量草酸,装置如图A所示(加热、搅拌和仪器固定装置均已略去):已知硝酸氧化淀粉水解液过程中可发生下列反应:

C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6?+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
实验过程如下:
将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,
水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入容器X中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。
请回答下列问题:
(1)容器X的名称:??????????????????????。
(2)冷凝管水的进口是????(填a或b);冷凝管冷凝回流的主要物质是 。
(3)实验中若混酸滴加过快,将导致草酸产量下降,其原因是?????????????????????。
(4)该装置最大的一个缺点是 。
(5)草酸重结晶的减压过滤装置如图B。仪器Y接在水龙头上,其作用是 。
减压过滤的操作有:①将含晶体的溶液倒入漏斗;②将滤纸放入漏斗并用水湿润;③打开水龙头;④关闭水龙头;⑤拆下橡皮管。正确的顺序是 。
(6) 将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2++ 10CO2↑+ 8H2O
称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1
的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液
颜色由????变为?????。滴定前后滴定管中的液面读数如图所
示,则该草酸晶体样品中二水合草酸的质量分数为??????????????。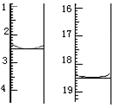
2、选择题 以下是某同学配置250mL 0.2mol/L的NaOH溶液的一些步骤,其中没有错误的是
A.在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.溶液配置完毕,立即将其转移至带橡胶塞的试剂瓶,贴上标签并洗涤容量瓶
3、实验题 谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡: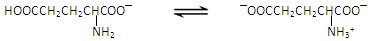
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是?????。
A.NaOH溶液、氨水、AgNO3溶液
B.H2SO4溶液、氨水、AgNO3溶液
C.NaOH溶液、CuSO4溶液
D.H2SO4溶液、CuSO4溶液
⑵“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是?????。
②滴定终点的实验现象为?????。
⑶味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,?????(填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L—1的AgNO3溶液,再加入少量?????溶液做指示剂,用浓度为c2mol·L—1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是?????。
4、实验题 “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水。某校化学兴趣小组欲探究该“脱氧剂”中Fe粉和活性炭质量之比,设计并进行了如下探究过程,请你参与实验并回答下列有关问题。
(1)取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”的铁已部分被_____________。
(2)将(1)中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是______________________;将滤渣分为两等份,每一份质量为8.0g将其中一份在氧气流中充分灼烧,生成的气体全部通入足量澄清石灰水,得到干燥、纯净的沉淀20.0g。8.0g滤渣中活性炭的质量为____________________。将另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。滤出不溶物。向滤液中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
(3)结论:该“脱氧荆”中的Fe粉和活性炭质量之比约为_____________________。
5、选择题 下列实验操作正确的是(??)
A.将氢氧化钠固体放在滤纸上称量
B.用10ml量筒量取8.58ml蒸馏水
C.制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集
D.配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度