微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 硫代硫酸钠(Na2S2O3)俗称海波,它可看成是用一个S原子取代了Na2SO4中的一个O原子而形成.某校化学研究性学习小组运用类比学习的思想,并通过实验探究Na2S2O4的化学性质.
[提出问题]Na2S2O3与Na2SO4结构相似,化学性质是否也相似呢?
[实验探究]取适量Na2S2O4晶体,溶于水中制成Na2S2O3溶液,进行如下探究.
实验操作
实验现象
现象解释(用离子方程式表示)
探究①
A.______
a.溶液pH=8
i.______
B.向pH=2的硫酸中滴加Na2S2O3溶液
b.______
ii.S2O32一+2H+═
S↓+SO2↑+H2O
探究②
C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液
c.氯水颜色变浅
iii.______
[实验结论]探究①:______.
探究②:______.
[问题讨论]
(1)甲同学向“探究②”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化.你认为该方案是否正确并说明理由______.
(2)请你重新设计一个实验方案,证明Na2S2O3被氯水氧化.你的方案______.
2、简答题 为探究氯气的性质,某同学做了如图1所示的实验,将少量试剂分别放入培养皿中的相应位置,已知:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.请回答下列问题:
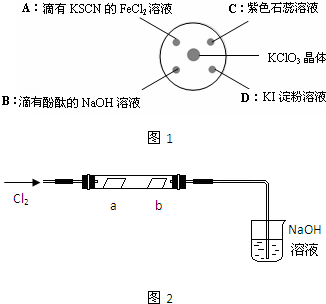
(1)用单线桥表示生成氯气的反应电子转移的方向和数目:______
KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O
(2)实验A的现象是______,反应的离子方程式为______.
(3)实验D的现象是______,反应的离子方程式为______,
这一实验说明氧化性Cl2______I2(填“>”或“<”).
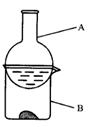
(4)实验C的现象是紫色石蕊溶液先变红,后褪色,使石蕊试液变红的反应的离子方程式为______.为了探究褪色原因,这位同学又做了如图2所示实验,将干燥的氯气通入双通管中,其中a为干燥的红纸条,b为湿润的红纸条.
①实验现象是:a______,b______.NaOH溶液的作用______.
②该实验说明具有漂白作用的物质是______.
③将氯气通入水中形成黄绿色的氯水,见光放置数天后黄绿色会褪去,同时失去漂白作用,原因是______(用化学方程式表示).
(5)实验B的实验现象是______,工业上利用与实验B类似的反应制备漂白粉,制漂白粉的化方程式为______.
3、选择题 有5种溶液,它们分别是:①KCl;②Ba(NO3)2;③NaOH;④(NH4)2SO4;⑤FeCl3.若要求不用任何外加试剂鉴别它们,则鉴别的先后顺序是( )
A.⑤④①③②
B.⑤③④②①
C.②④③①⑤
D.③②④⑤①
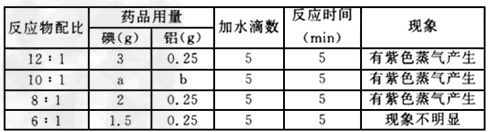
4、实验题 某学生实验小组用如下图装置探究不同配比反应物的用量对碘与铝反应(水做催化剂)的影响,实验数据见下表。???????
请回答下列问题: ???
(1)实验装置中A的名称____。 ???
(2)表中a=?_______,b=____。 ???
(3)实验现象中的紫色蒸气是_______,该现象说明铝和碘的反应 ____(填“吸热”或“放热”)。 ???
(4)依据上表有关数据,分析碘与铝反应最适合学生分组实验操作的配比是____,理由是____________。
(5)实验后有同学想检验该反应的产物就是碘化铝,进行如下实验,请将实验步骤补充完整(所用试剂任选)。??????

(6)将提纯后的碘化铝用蒸馏水溶解,分析溶液中碘离子与铝离子的物质的量之比小于3:1的原因(用离子方程式表示)是___________。
5、选择题 下列有关物质性质实验的叙述,正确的是
A.钠在空气中燃烧,生成淡黄色的氧化钠粉末
B.镁在二氧化碳中燃烧,生成白色的氧化镁和黑色的炭
C.将灼热的铁丝放人盛有氯气的集气瓶中,生成棕黄色的氯化铁烟雾
D.在铜和浓硫酸加热反应后的混合液中加水,得到无色硫酸铜溶液
|