微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 由A和B两种盐组成的混合物,进行了下列实验:
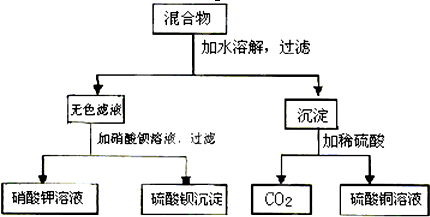
试判断后填写下列空格:
(1)A、B是______和______.
(2)写出实验过程中发生反应的离子方程式:
①混合物加水时______;
②无色滤液加硝酸钡溶液______;
③沉淀加稀硫酸______.
参考答案:(1)根据质量守恒知混合物中含有:SO42-、Cu2+、CO
本题解析:
本题难度:一般
2、简答题 (14分)硒(34Se)和碲(52Te)都是第VIA族元素,硒是分布在地壳中的稀有元素。工业上硒鼓废料(主要成分硒、碲、碳、铜和铁合金)回收精炼硒的流程如下:

已知:
物理性质
| 熔点
| 沸点
| 升华
| 溶解性
|
SeO2
| 340℃
| 684℃
| 315℃
| 易溶于水
|
TeO2
| 733℃
| 1260℃
| 450℃
| 微溶于水
(1)Se的氢化物的电子式是______。
(2)步骤①中通入的氧气使硒鼓废料翻腾,目的是______。
(3)废气的主要成分是______;废渣II的主要成分是______。
(4)步骤④中主要反应的化学方程式是______;步骤⑥反应的化学方程式是______。
(5)根据表中数据,步骤⑤最适宜的分离方法是______。
参考答案:(14分)
(1) 本题解析: 本题解析:
试题分析:(1)Se是第六主族元素,氢化物的化学式与H2O相似,属于共价化合物,电子式为 ; ;
(2)步骤①中通人的氧气使硒鼓废料翻腾,目的是增大接触面积,加快反应速率,使废料充分燃烧
(3)根据硒鼓废料的成分判断,废气是CO2;SeO2易溶于水,TeO2微溶于水,所以废渣主要是TeO2;
(4)SeO2溶于水生成H2SeO3,受热分解生成SeO2,化学方程式为H2SeO3 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4 SeO2+H2O;步骤⑥发生氧化还原反应 ,根据所给反应物和产物写出其化学方程式:2H2SeO3+SeO2=Se+2H2SO4
(5)根据SeO2和TeO2升华的温度,二者分离的最适宜方法是升华,将温度控制在315℃到450℃之间
本题难度:一般
3、实验题 (14分)某研究小组对铁生锈进行研究:

(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是?????(填字母),铁锈的主要成分是?????????????
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为???????????????
(3)铁生锈的外部条件是?????????????????????????????;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为???????????????????????????????????????
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是?????
A. 锡???????? B. 铜???????? C. 锌????
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2??????????????????? B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH???? D. 不需加入任何物质而直接使用
参考答案:(14分)(1)A,? Fe2O3(或 Fe2O3· xH2
本题解析:(1)B、C都不能隔绝空气,防止铁发生电化学腐蚀,而A不能,所以最容易倍腐蚀的是A。铁锈的主要成分是Fe2O3(或 Fe2O3· xH2O)。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。
本题难度:一般
4、选择题 下列有关实验原理或实验操作正确的是
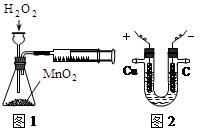
A.利用右图1装置定量测定H2O2的分解速率
B.利用右图2装置模拟工业上电解饱和食盐水
C.配制FeCl3溶液时加入少量盐酸,以防止溶液浑浊
D.用HNO2溶液做导电性实验,灯光较暗,说明HNO2是弱电解质
参考答案:C
本题解析:
试题分析:A.利用右图1装置定性测定H2O2的分解速率;
B.利用右图2装置模拟工业上电解饱和食盐水,必须把外接电源的正负极换换才可以;
D.用HNO2溶液做导电性实验,灯光较暗,不能说明HNO2是弱电解质。
故选C。
点评:解答本题需要注意的是,导电性和电解质的强弱无关,和导电离子的浓度和所带电荷的多少有关。
本题难度:简单
5、填空题 (12分).现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而得到较为纯净的NaNO3。实验流程可用下图表示:
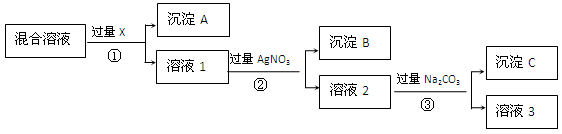
请回答下列问题:
(1)写出实验流程中下列物质的化学式:
试剂X:??????,沉淀B:???????????。
(2)实验流程中加入过量的Na2CO3的目的是?????????????。
(3)实验方案得到的溶液3中肯定含有??????(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的????,请写出所发生反应的离子方程式_______________。
参考答案:(1) BaCl2或Ba(NO3)2、AgCl (2) 使溶
本题解析:略
本题难度:一般
|