微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 .利用下图装置可测定m g纯碱样品(含少量NaCl)中Na2CO3的质量分数.
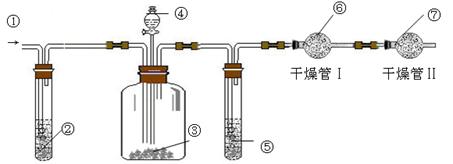
(A)?????????(B)??????????(C)???
(1)实验中使用的药品可能有:a.浓H2SO4、b.稀硫酸、c.稀盐酸、d.纯碱样品、e.碱石灰、f.NaOH溶液、g.空气.请将这些药品的盛装部分对号入座(必要时可重复使用),请填写对应的序号:
①?????、②?????、③?????、④?????、⑤?????、⑥??????、⑦??????.
(2)实验中使用了空气,其作用是??????????????????????;若通入空气的速度过快或通入空气的量不足,则所测定Na2CO3的含量???????(填“偏高”、“偏低”或“准确”).
(3)干燥管Ⅱ的作用是???????????????????????????????,若缺乏干燥管Ⅱ,其后果是??????????????????????.
(4)若分液漏斗中④的滴液速度过快,将导致实验结果?????(填“偏高”、“偏低” 和“准确”).
(5)若干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则样品中Na2CO3的质量分数的数学表达式为?????????。
参考答案:(1)① g?② f?③? d?④b ?⑤? a ?⑥? e
本题解析:(1)根据装置图可知,实验原理是利用碳酸钠和酸生成CO2,如果吸收CO2来计算碳酸钠的质量,由于生成的CO2中含有水蒸气,所以在通入碱石灰之前,还需要首先除去水蒸气。又因为装置中会残留CO2,所以还必需通入空气排尽装置的CO2。但其中也含有CO2,所以通入的可知首先要除去CO2,且还必需防止空气中的水蒸气和CO2被碱石灰吸收,所以正确顺序是① g?② f?③? d?④b ?⑤? a ?⑥? e ?⑦? e 。
(2)根据以上分析可知,使用空气的目的是使反应产生的CO2气体充分排出;;若通入空气的速度过快或通入空气的量不足,则生成的CO2不能完全气被吸收,因此结果偏低。
(3)由于空气中也含有水蒸气和CO2,所以干燥管Ⅱ的作用是防止空气中的CO2和H2O被吸入干燥管Ⅰ中;如果没有该装置,则吸收的CO2增加,碳酸钠的质量分数会偏大。
(4)若分液漏斗中④的滴液速度过快,则碳酸钠反应不完全,生成的CO2减少,测定结果偏低。
(5)干燥管Ⅰ内药品的质量实验前为m1 g,实验后为m2 g,则生成的CO2质量是(m2-m1)g,所以碳酸钠的质量就是(m2-m1)÷44×106,因此质量分数是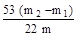 ×100%.。
×100%.。
本题难度:一般
2、实验题 草酸合铁酸钾晶体Kx[Fe(C2O4)y]·3H2O可用于摄影和蓝色印刷。实验室制备草酸合铁酸钾晶体的实验流程如下:
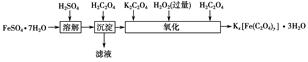
(1)若用铁和稀硫酸制备FeSO4·7H2O,常保持______过量,理由是___________________________________________________。
(2)上述流程中,“沉淀”一步所得FeC2O4·2H2O沉淀需用水洗涤。检验沉淀是否洗涤干净的方法是_________________________________________________________________。
(3)测定草酸合铁酸钾产品中Fe3+含量和C2O42-含量的实验步骤如下:
步骤1:准确称取所制草酸合铁酸钾晶体a g(约1.5 g),配成250 mL待测液。
步骤2:用移液管移取25.00 mL待测液于锥形瓶中,加入6 mol·L-1 HCl 10 mL,加热至70~80 ℃,趁热用SnCl2TiCl3联合还原法将Fe3+全部还原为Fe2+,加入MnSO4溶液10 mL,在75~80 ℃下用0.010 00 mol·L-1 KMnO4标准溶液滴定至终点(Cl-不参与反应),将C2O42-全部氧化成CO2,Fe2+全部氧化成Fe3+记录体积。
步骤3:……
步骤4:重复上述步骤2~步骤3两次。
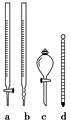
①步骤2操作时,还需要使用如图所示仪器中的________(填序号)。
②步骤2中MnSO4溶液的作用是________,滴定终点的现象是______________________________________。
③在不增加试剂种类的前提下,步骤3的目的是_________________________。
参考答案:(1)铁 防止Fe2+被氧气氧化
(2)取少量最后一次
本题解析:(1)铁和稀硫酸制备FeSO4·7H2O,保持一种物质过量,主要是硫酸,因为在获得晶体的过程中抑制Fe2+的水解。(2)沉淀洗涤是否干净,主要是沉淀中所含的可溶性杂质是否存在,首先分析杂质可能是K2SO4,可以通过检验SO42-检验洗涤是否干净。(3)①注意测定过程中要控制温度,选择温度计,方法是通过利用KMnO4滴定,选用酸式滴定管。②滴定过程中MnO4-被还原为Mn2+,先加入Mn2+可能是作催化剂。滴定终点时,KMnO4过量,此时溶液呈浅红色,且半分钟内不褪色。③本实验的目的是测定Fe3+和C2O42-,而测定过程中,是先将Fe3+还原为Fe2+,然后利用KMnO4滴定氧化Fe2+、C2O42-,无法分别出Fe2+、C2O42-各自的量,只有总量,因此还需要滴定出Fe2+或C2O42-,由题可知滴定C2O42-更容易,因为可以另取溶液,直接滴定,因为此时铁为Fe3+不与KMnO4反应。
本题难度:一般
3、实验题 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
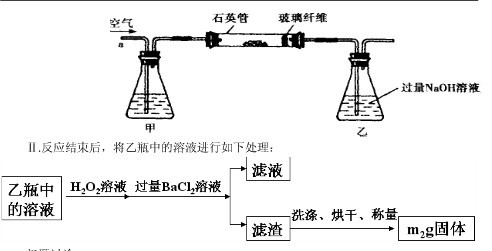
Ⅰ、将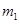 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2 2Fe2O3+8SO2?
2Fe2O3+8SO2?
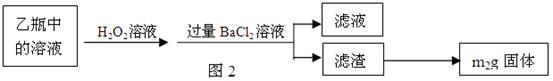
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
[实验二]测定铁元素的含量。
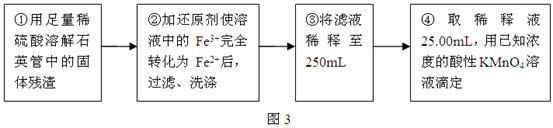
Ⅲ、测定铁元素含量的实验步骤如图3所示:
问题讨论:
 ??
??
(1)Ⅰ中,甲瓶内所盛试剂是???????溶液。乙瓶内发生反应的离子方程式有:
????????????????????????????、????????????????????????????。
(2)Ⅱ中的滤渣在称量前还应进行的操作是???????????????????????????????????。
(3)Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是?????????????????????????。
(4)Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有????????。
写出④中反应的离子方程式??????????????????????????????????。
(5)该黄铁矿中硫元素的质量分数为?????????????????。
参考答案:(1)NaOH (2分)  本题解析:(1)由于空气中含有CO2和水蒸气,所以必须除去,以防止干扰后面的SO2的吸收,因此盛放的是氢氧化钠溶液。SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的方程式是SO2+2OH-=SO32-+H2O。又因为亚硫酸钠极易被氧气氧化,所以还可能发生反应2SO32-+O2=2SO42-。
本题解析:(1)由于空气中含有CO2和水蒸气,所以必须除去,以防止干扰后面的SO2的吸收,因此盛放的是氢氧化钠溶液。SO2是酸性氧化物,能被氢氧化钠溶液吸收,反应的方程式是SO2+2OH-=SO32-+H2O。又因为亚硫酸钠极易被氧气氧化,所以还可能发生反应2SO32-+O2=2SO42-。
(2)沉淀在称量之前还需要洗涤和干燥。
(3)为了使溶液中的SO32-完全被氧化生成SO42-,加入的过氧化钠应该是过量的。
(4)由于要稀释至250ml,所以还需要250ml容量瓶。酸性高锰酸钾溶液具有氧化性,能氧化亚铁离子,反应的方程式是5Fe2+ + 2MnO4-+16H+==5Fe3++2Mn2++8H2O。
(5)硫酸钡的质量是m2g,物质的量是m2/233mol,则SO2的物质的量是m2/233mol,所以硫元素的质量分数是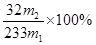 。
。
本题难度:一般
4、选择题 下列化学实验或操作能够达到目的的是
A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量
B.欲除去蛋白质溶液中的NaCl而又不改变其性质,可加入适量BaCl2溶液后过滤
C.测氯水的pH,可用玻璃棒蘸取氯水点在pH试纸上,待其变色后和标准比色卡比较
D.为了证明焦炉气中含有氢气,可将焦炉气通过灼热的氧化铜粉末,看黑色粉末是否变红色
参考答案:A
本题解析:
试题分析:A中氢氧化钠和氯化钾不反应,和氯化铝反应生成白色沉淀,氢氧化钠过量时沉淀又溶解。和氯化镁反应生成白色沉淀,氢氧化钠过量时,沉淀不溶解,可以鉴别,A正确;B中氯化钡是重金属盐,能使蛋白质变性,而变性是不可逆的,达不到提纯的目的,B不正确;氯水具有强氧化性,能使Ph试纸氧化而褪色,不能测定其pH值,C不正确;焦炉气中还含义CO,CO也具有还原性,能把氧化铜还原生成单质铜,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。侧重对学生实验能力的考查,有利于培养学生规范、严谨的实验设计能力,也有助于培养学生的灵活应变能力。化学实验基本操作,是高考中的热点和重点,需要平时注意知识的积累和总结,该题的易错点是选项C。
本题难度:简单
5、实验题 下图是用来进行乙醇的氧化和氧化产物的检验的实验装置。可供选择的试剂有:氧化铜粉末、乙醇、新制氢氧化钙悬浊液、银氨溶液,溴水、高锰酸钾溶液所需其他仪器任选。(不考虑装置内空气的存在)
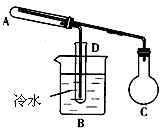
(1)做乙醇氧化实验时,C中应装___________________。
(2)在_________处加热,实验一段时间后A处的实验现象___________________。
(3)在检验乙醇氧化产物时,对B、D的具体操作方法为___________________。其中反应的化学方程式为___________________。
参考答案:(1)酒精
(2)AC;固体由黑变红(管口有液滴)<
本题解析:
本题难度:一般