微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)(1)要除去MgCl2酸性溶液里少量的Fe3+,可选用的试剂是 (填序号) 。
A.MgO
B.MgCO3
C.NaOH
D.Mg(OH)2
E.Fe(OH)3
(2)某温度下纯水中C(H+)=2×10-7 mol/L,则此时溶液中的C(OH-) = ;若温度不变,滴入稀盐酸使C(H+)=5×10-6 mol/L,则此时溶液中的C(OH-) = 。
(3)某温度下纯水的c(H+)=1.0×10-6 mol?L-1,在此温度下,将pH=8的Ba(OH)2与pH=5的稀盐酸混合,欲使pH=7,则Ba(OH) 2与稀盐酸的体积比为 。
参考答案:(1)ABD (2) 2×10-7 m
本题解析:
试题分析:(1)根据FeCl3的水解:FeCl3+3H2O Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去,又不会引入新杂质。(2)纯水中 C(OH-) = C(H+) = 2×10-7 mol/L,Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14,稀盐酸中 C(OH-) ="Kw/" C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L。(3)纯水
Fe(OH)3+3HCl,加入MgO、Mg(OH)2、MgCO3均能促进FeCl3的水解,使其转化Fe(OH)3沉淀而除去,同时过量的MgO、Mg(OH)2、MgCO3可通过过滤除去,又不会引入新杂质。(2)纯水中 C(OH-) = C(H+) = 2×10-7 mol/L,Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14,稀盐酸中 C(OH-) ="Kw/" C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L。(3)纯水 说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,解得x:y=2:9,
说明,pH=6溶液呈中性,设Ba(OH)2溶液的体积为x,盐酸的体积为y,pH=8的Ba(OH)2溶液,c(OH-)=10-6mol/L,pH=5的盐酸,c(H+)=10-5mol/L,酸碱混合后,pH=7,则溶液呈碱性,反应剩余 c(OH-)="0.1" mol/L,则(10-6×x-10-5y)/( x+y) ="0.1" mol/L,解得x:y=2:9,
考点:考查物质的分离提纯,酸碱混合时的定性判断及有关ph的计算。
本题难度:一般
2、选择题 蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
A.FeCl3
B.FeCl3·6H2O
C.Fe(OH)3
D.Fe2O3
参考答案:D
本题解析:FeCl3在水中发生水解:FeCl3+3H2O Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
Fe(OH)3+3HCl,加热促进水解,由于HCl具有挥发性,会从溶液中挥发出去,从而使FeCl3彻底水解生成Fe(OH)3,Fe(OH)3为不溶性碱,受热易分解,最终生成Fe2O3。
本题难度:一般
3、填空题 制备锌印刷电路板是用稀硝酸腐蚀锌板,产生的废液称“烂板液”。“烂板液”中含硝酸锌外,还含有自来水带入的Cl—和Fe3+。在实验室里,用“烂板液”制取ZnSO4·7H2O的过程如下:

(1)若稀硝酸腐蚀锌板时还原产物为N2O,氧化剂与还原剂的物质的量之比是 。
(2)若步骤①的pH>12,则Zn(OH)2溶解生成四羟基合锌酸钠。写出Zn(OH)2被溶解的离子方程式 。
(3)滤液D中除了含有OH—离子外,还含有的阴离子有 (填离子符号)。
(4)若滤液E的pH=4,c(Zn2+)=2mol·L-1,c(Fe3+)=2.6×l0-9mol·L-1,能求得的溶度积是 (填选项)。
A.Ksp[Zn(OH)2] B.Ksp[Zn(OH)2]和Ksp[Fe(OH)3] C.Ksp[Fe(OH)3]
(5)步骤③要控制pH在一定范围。实验室用pH试纸测定溶液pH的方法是: 。
(6)已知:①Fe(OH)3(s) Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
②H2O(l)  H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
H+(aq)+OH-(aq) ;ΔH=" b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式: 。
若①的溶度积常数为KSP,②的离子积常数为KW,Fe3+发生水解反应的平衡常数:
K= 。(用含KSP、KW的代数式表示)
参考答案:(1)1:2
(2)Zn(OH)2+2OH-=ZnO2
本题解析:
试题分析:(1)4Zn+10HNO3 4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
4Zn(NO3)2+N2O+5H2O,HNO3做氧化剂,但是10molHNO3里面发生化合价改变只有2mol,Zn做还原剂,所以氧化剂与还原剂的物质的量之比是1 :2。
(2)偏铝酸钠在水溶液中都是以Na[Al(OH)4]的形式存在,以前只不过是为了方便,把它简写成NaAlO2。但它的实际组成还是Na[Al(OH)4]。 NaAlO2偏铝酸钠是简写,就像氢离子(H+)实际上是水合氢离子一样。[Zn(OH)4]-与此相类似。
(4)在一定条件下,难溶强电解质AmBn溶于水形成饱和溶液时,溶质的离子与该固态物质之间建立动态平衡,叫作沉淀溶解平衡。这时,离子浓度的乘积为一常数,叫作溶度积,用Ksp表示。很明显,滤液E的pH=4时,Zn(OH)2已经溶解,所以无法求得溶度积,而Fe(OH)3是已沉淀形式存在,所以可以求得。
(6)由②×3-①即可得到Fe3+(aq) +3H2O(l)  Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Fe(OH)3(s) +3H+(aq) △H=(3b-a)kJ·mol-1 。
Ksp[Fe(OH)3]=c(Fe3+)·c3(OH-) KW=c(OH-)·c(H+)
Fe3+发生水解反应的平衡常数:K=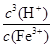 =
=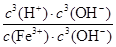 =
=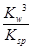
考点:考查化学综合运用。
本题难度:困难
4、选择题 常温下,用 0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到2条滴定曲线,如下图所示,则下列说法正确的是

A.图2是滴定盐酸的曲线
B.a与b的关系是:a<b
C.E点对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.这两次滴定都可以用甲基橙作为指示剂且颜色变化为红变橙
参考答案:C
本题解析:
试题分析:A.图2在开始滴定时溶液的pH=3,而盐酸是强酸,完全电离,0.10 mol·L-1 HCl的pH=1,与实际情况不符合,所以这是滴定醋酸的曲线,错误;B.由于盐酸与醋酸的浓度相等,体积相同,所以当滴定达到溶液d的pH=7时,a与b的关系是:a>b,错误;C.在E点时溶液为酸性溶液,对应离子浓度由大到小的顺序为: c(CH3COO-)>c(Na+)>c(H+)>c(OH-),正确;D.用碱滴定酸时,为了减小滴定误差,应该选择溶液的颜色由浅到深的的变化的酚酞作指示剂,颜色变化为无色变红色,错误;
考点:考查酸碱中和滴定时的滴定曲线、消耗溶液的体积、离子浓度的大小比较、和指示剂的选择的知识。
本题难度:一般
5、选择题 下列有关物质用途的叙述中不正确的
A.碳酸氢钠可用于治疗胃酸过多
B.氧化铝可用于制耐火砖,坩埚等
C.硅是光导纤维和制造太阳能电池的主要原料
D.Al2(SO4)3和Fe2(SO4)3均可除去河水中的悬浮颗粒
参考答案:C
本题解析:分析:A、根据碳酸氢钠的用途;
B、根据氧化铝的用途;
C、根据硅和二氧化硅的用途;
D、根据Al2(SO4)3和Fe2(SO4)3的用途;
解答:A、碳酸氢钠可用于治疗胃酸过多、作发酵剂,故A正确;
B、氧化铝可作耐火材料,用于制耐火砖,坩埚等,故B正确;
C、二氧化硅是光导纤维的主要原料,硅是制造太阳能电池的主要原料,故C错误;
D、Al2(SO4)3和Fe2(SO4)3均可作净水剂,除去河水中的悬浮颗粒,故D正确;
故选:D.
点评:本题主要考查了物质的用途,掌握物质的性质是解题的关键.
本题难度:一般