微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 0.1 mol / L Na2CO3和0.1 mol / L NaHCO3溶液的pH值比较(????)
A.大于
B.等于
C.小于
D.不能肯定
参考答案:A
本题解析:
试题分析:Na2CO3溶液中CO32?水解,NaHCO3溶液中HCO3?水解,CO32?的水解程度大于HCO3?的水解,所以0.1 mol / L Na2CO3溶液的pH大,故A项正确。
本题难度:一般
2、选择题 某溶液中仅含有Na+、H+、OH—、CH3COO-四种离子,下列说法错误的是
A.若溶液中离子间满足:c(CH3COO—)=c(Na+)则该溶液一定呈中性
B.该溶液中一定满足: c(CH3COO—)>c(CH3COOH)>c(OH—)>c(H+)
C.溶液中四种离子之间可能满足:c(Na+)>c(OH-)>c(CH?3COO—)>c(H+)
D.若溶液中的溶质是CH3COONa和CH3COOH,则溶液中离子间一定满足:
c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
参考答案:BD
本题解析:根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH?3COO—)可知,A正确,C正确。B说明溶液显碱性,因此c(OH—)有可能大于c(CH3COOH),B不正确。若溶液中的溶质是CH3COONa和CH3COOH,则溶液不一定显酸性,D不正确。答案选BD。
本题难度:一般
3、选择题 25℃时,1 mol/L的NH4Cl、CH3COONH4、NH4HSO4、NH3·H2O四种溶液中,测得c(NH)分别为a、b、c、d(单位为mol/L),下列判断正确的是(???)
A.a=b=c=d
B.a>b>d>c
C.d >a>c>b
D.c>a>b>d
参考答案:D
本题解析:氨水是弱碱在溶液中部分电离,其余均为盐在溶液中全电离,所以氨水中铵根离子的浓度最小即d最小;根据铵根离子的水解平衡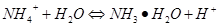 ,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)
,NH4HSO4溶液中存在氢离子会抑制铵根的水解溶液中铵根离子的浓度最大,醋酸根离子是弱酸根离子会促使铵根的水解平衡向右移动,铵根离子浓度减小,氯离子对铵根的水解平衡没有影响,综上可以得出c(NH)
本题难度:简单
4、填空题 常温下将0.01molCH3COONa和0.004mol盐酸溶于水,配成0.5L混合溶液。
(1)溶液中共有??????????????????________种微粒。
(2)溶液中有两种微粒的物质的量之和一定等于0.01mol,它们是____________。
(3)溶液中n(CH3COO-)+n(OH-)-n(H+)=_________mol。
参考答案:(1)7???(2)CH3COOH和CH3COO- ???(
本题解析:(1)醋酸钠溶液盐酸,发生反应CH3COONa+HCl=CH3COOH+NaCl。根据物质的量可知,醋酸钠过量,即溶液中含有0.006mol醋酸钠、0.004mol醋酸和0.004mol氯化钠。醋酸存在电离平衡,醋酸钠存在水解平衡,所以含有的微粒是CH3COOH、H2O、H+、OH-、CH3COO-、Na+、Cl-共计是7种。
(2)根据原子守恒可知,CH3COOH和CH3COO-的物质的量之和一定等于0.01mol。
(3)根据电荷守恒可知n(CH3COO-)+n(OH-)+n(Cl-)=n
本题难度:一般
5、选择题 已知25 ℃时有关弱酸的电离平衡常数:
弱酸化学式
| CH3COOH
| HCN
| H2CO3
|
电离平衡常数(25 ℃)
| 1.8×10-5
| 4.9×10-10
| K1=4.3×10-7 K2=5.6×10-11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1HCN溶液与b mol·L-1NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.冰醋酸中逐滴加水,则溶液的导电性、电离度均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO)+2c(CO)
参考答案:D
本题解析:重点考查盐类的水解。
A:由越弱越水解知,pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),选项错。
B:所得溶液中c(Na+)>c(CN-),说明c(H+)<c(OH-),溶液呈碱性;如果a=b,最终溶液即为NaCN溶液完全符合题意,本选项错。
C:冰醋酸中逐滴加水,溶液的导电性先增大后减小,电离度是一直在增大。选项错。
D:由电荷守恒可知本选项正确。
本题难度:一般
|